
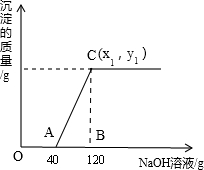
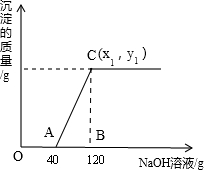
有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如下图所示。若HCl在混合溶液中质量分数为3.65%。求:
(1)A点溶液的溶质化学式为 ;
(2)与盐酸反应的氢氧化钠质量为 g。
(3)恰好沉淀完全时,C点所得溶液中溶质的质量分数是多少?(结果精确到0.1% ,写出计算过程)
NaCl,MgCl2;40g;8.2%
解析试题分析:(1)由图中数据可知,开始加入氢氧化钠溶液,没有沉淀生成,说明是氢氧化钠先与盐酸反应,而MgCl2尚未反应;至A点时,氢氧化钠与盐酸恰好完全反应,生成氯化钠和水,故A点溶液的溶质化学式为生成的NaCl和未反应的MgCl2。
(2)由于至A点时,氢氧化钠与盐酸恰好完全反应,故可根据盐酸的质量,利用二者反应的化学方程式,可求出参加反应的氢氧化钠的质量
设与盐酸反应的氢氧化钠溶液的质量为x
NaOH + HCl =" NaCl" + H2O
40 36.5
x×10% 100g×3.65%
40:36.5=(x×10%):(100g×3.65%)
解得,x=40g
即与盐酸反应的氢氧化钠质量为40g。
(3)根据题意可知,MgCl2和氢氧化钠反应,生成氢氧化镁沉淀和氯化钠,结合图示可知,反应至C点时,二者恰好完全反应,溶液中的溶质为氯化钠;且氯化钠来自于两部分:氢氧化钠与盐酸反应生成的氯化钠,MgCl2和氢氧化钠反应生成的氯化钠;最后根据“溶质质量分数=  ×100%”计算即可。
×100%”计算即可。
结合图示数据可知,与MgCl2反应的氢氧化钠溶液的质量为120g-40g=80g,
设MgCl2和氢氧化钠反应生成的氯化钠的质量为y,生成的氢氧化镁沉淀的质量为m
2NaOH + MgCl2 =" 2NaCl" + Mg(OH)2↓
80 117 58
80g×10% y m
80:117=(80g×10%):y
解得,y=11.7g
80:58=(80g×10%):m
解得,m=5.8g
设氢氧化钠与盐酸反应生成的氯化钠的质量为z,
HCl + NaOH = NaCl + H2O
36.5 58.5
100g×3.65% z
36.5:58.5=(100g×3.65%):z
解得,z=5.85g
所以,C点所得溶液中溶质的质量分数= ×100%=×8.2%。
×100%=×8.2%。
考点:酸、碱、盐的化学性质,书写化学方程式,根据化学反应方程式的计算
点评:此题是关于化学方程式及溶质质量分数的计算题,要求学生有较强的识图能力和数据分析能力,解题的关键是根据图像找出恰好完全反应时各物质的质量,再利用相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,对于反应后的溶质要注意其组成来自于两部分(两个反应所得)。


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
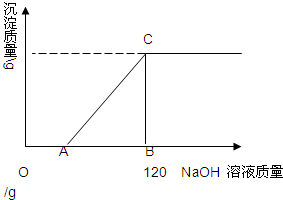 有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:
有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
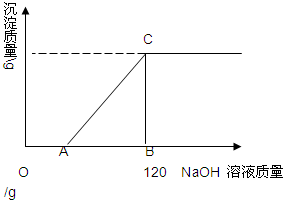 有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:
有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com