
����Ŀ��̽������ɷ֡��ҹ���ѧ�Һ�°��ڰ���Ļ����ϴ����˺����Ƽ�����������̼�������ͼ��
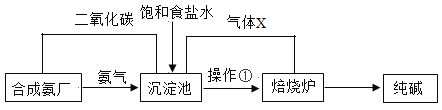
���������ͼ�ش��������⣺
��1��д���������з�����Ӧ�Ļ�ѧ����ʽ___________��
��2����������������X�Ļ�ѧʽ��___________
��3���������о���ת��������¯ʱ�õ������٣������ٵ�������____________��
��4�����������Ƽ���ƵõĴ����п��ܺ���̼�����ơ��Ȼ��Ƶ����ʣ���ѧ��ȤС���ijƷ�ƴ�����Ʒ�ijɷּ�����������ʵ��̽��
������ʵ�飩̽����Ʒ�ijɷ�
ʵ�鲽�� | ʵ������ | ʵ�����. |
_______ | _______ | ��Ʒ�в���̼������ |
_______ | _______ | ��Ʒ�к����Ȼ��� |
������ʵ�飩������Ʒ��ϡ���ᷴӦ���ⶨNa2CO3������������ʵ��װ�ã�����̨��ȥ������ͼ��ʾ����װ�����������ã���������Ļӷ�����ÿ����Ӧ�����ö�����ȫ�ģ���
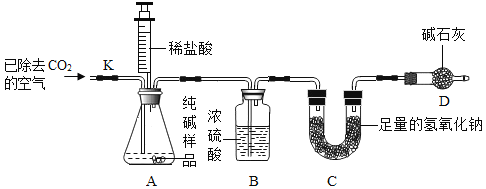
ʵ�鲽�裺
1���װ�õ������ԣ���6g������Ʒ������ƿ��
2������ӦǰCװ������Ϊ50g
3��װװ�ã���ע������A�м���50mLϡ����ʱ��A�в��ٲ������ݡ�
4��ֹˮ��K��ͨ���ѳ�ȥCO2�Ŀ�����һ��ʱ���ر�ֹˮ��
5����װ��C��Ӧ�������Ϊ52.2g
��5�������۷���������4��������______________��ȱ��װ��B������ʹ�ⶨ���____________��ѡ����ƫ��������ƫС��������������.
�ڸ������е����ݼ��㴿����Ʒ��̼���Ƶ���������Ϊ____________����������ȷ��0.1%����
���𰸡�![]() CO2 ���� ȡ��Ʒ���Թ��ڼ��ȣ�������������ͨ������ʯ��ˮ ʯ��ˮ������� ��ȡ��Ʒ���Թ��У��������ϡ���ᣬ���ټ�����������Һ �������ݲ������ڲ�����ɫ���� ʹװ���ڲ����Ķ�����̼���ܱ����գ����ž�װ���ڵĶ�����̼�� ƫ�� 88.3%
CO2 ���� ȡ��Ʒ���Թ��ڼ��ȣ�������������ͨ������ʯ��ˮ ʯ��ˮ������� ��ȡ��Ʒ���Թ��У��������ϡ���ᣬ���ټ�����������Һ �������ݲ������ڲ�����ɫ���� ʹװ���ڲ����Ķ�����̼���ܱ����գ����ž�װ���ڵĶ�����̼�� ƫ�� 88.3%
��������
��1���������й����Ķ�����̼�백����ˮ�Լ��Ȼ��Ʒ�Ӧ����̼�����ƺ��Ȼ�淋Ļ�ѧ����ʽ��![]() ��
��
��2������������ʹ�ù����Ķ�����̼���壬����X�Ļ�ѧʽ�ǣ�CO2��
��3���������о���ת��������¯ʱ�õ������Һ�����IJ����٣������ٵ������ǣ����ˣ�
��4������ʵ��һ��ȡ��Ʒ���Թ��ڼ��ȣ�������������ͨ������ʯ��ˮ����ʯ��ˮ������ǣ�˵��û�ж�����̼�������������Ʒ�в���̼�����ƣ�
ʵ�����ȡ��Ʒ���Թ��У��������ϡ���ᣬ�����ݲ������ټ�����������Һ����������ɫ���������������Ȼ��Ʒ�Ӧ�ܲ����Ȼ�����ɫ����������Ʒ�к����Ȼ��ƣ�
��5�������۷���������4�������ǣ��ž�װ���ڵĶ�����̼����ֹ����ʵ�飬ȱ��Ũ����װ��B������ˮ���������Cװ�ã�������������ƫ����ʹ�ⶨ���ƫ��
�ڽ⣺��װ��C�������仯��֪��������̼������Ϊ52.2g-50g=2.2g��
�裺�μӷ�Ӧ̼���Ƶ�����Ϊx��
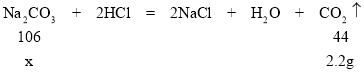
![]() x=5.3g
x=5.3g
������Ʒ��̼���Ƶ���������=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о�С���������Ҫ��̼����Ԫ����ɣ�ȼ�ս���������̽����
��1�����ͼ 1 ��ʾʵ�飬��ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_____�����Ʋ⿿����ͨ��_____����Ͽڡ����� �ڡ����Ļ�����Ϩ��������_____��
��2��ijͬѧ�ô��ձ����ߵ� 2 ֧ȼ�յ�������ס���۲쵽�ߵ�������Ϩ�𣬵͵������Ϩ��
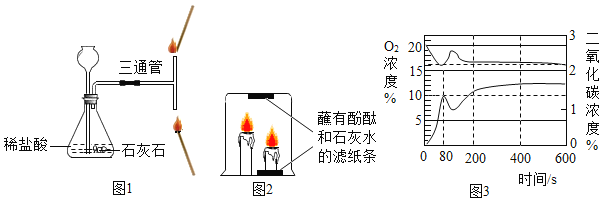
��������⣩���¸ߵ�������Ϩ���ԭ����ʲô��
����������裩
���� 1�������Ǹ�������渽���Ķ�����̼��������������Ϩ��
���� 2�������Ǹ�������渽��������Ũ�ȹ��͵�������Ϩ��
�����ʵ�飩
��ͬѧ��ͼ 2 װ�ý���ʵ�飬��ȼ�����ô��ձ���ס��һ��ʱ����������ձ����ϲ�����ֽ������ɫ��˵����ʱ�������Ķ�����̼Ũ�ȱȵ�������Ũ��_____����ߡ��͡�����
��3��Ϊ��һ����֤���� 1����ͬѧ�ռ� 1 ƿ�� 20%������ 80%������̼�����壬����ȼ��������������ƿ�в��ܱգ������ȼһ��ʱ�������Ϩ�𣬸���ʵ�������֪������ 1_____���������������������
��4����ͬѧʹ�ô���������ܱ�װ���������ȼ�յ�Ϩ���Ĺ����У�80 s ʱ����Ϩ�𣩣�װ���������Ͷ�����̼�����ı仯������ͼ 3 �� ��ɵ�����ȼ�յ�������_____��
��5���������֪ʶ������ʵ���������ͬѧʵ���У�������ȫϨ���ƿ�ں��е�������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ�Ȼ�����Ʒ�е�̼�������ʣ���ȤС�������������µķ���������ʵ�飮
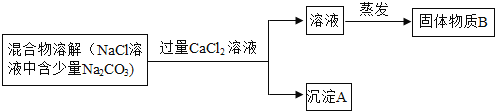
��1��д������A�Ļ�ѧʽ ______ ��
��2������CaCl2��Һ�����ȥ����A��ʵ����������� ______ ��
��3��ͬѧ��ʵ������У��ַ������µ����⣺�˷��������������µ����ʣ���д����������B�ijɷ� ______ ���û�ѧʽ��ʾ����
��4��ͬѧ����̽����������µķ�������������ܽ⣬���μ����������ٲ�������Ϊֹ������ܳ�ȥNa2CO3���ʣ�������Ч�ط�ֹ�����ʵ����룮д���йط�Ӧ�Ļ�ѧ����ʽ�� ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ȫ���ʹ����췼��̶��Ȫˮ�и���뱡�ﮡ���̼���μ������εȶ��ֶ���������ijɷ֡���ش�
��1�������ʷ������Ȫˮ����______________��
��2��������Ȫˮ��Ӳˮ������ˮ����ѡ�õ�������_________��
��3����Ȫˮ�е�������������ָ����_______������Ԫ������ԭ������������������
��4�����۽Ƕȷ������ʻ��ظ������ŵ��������ԭ����________��
��5��t��ʱ�����Ƹ���Ȫ�е�ij��̼���α�����Һ�����ø���̼���κ�ˮ��������ϵ��ͼ��ʾ��
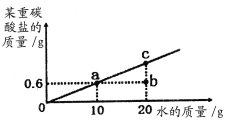
��t��ʱ����̼���ε��ܽ��Ϊ_________g��
��b��c��������ʾ����Һ���������������Ĵ�С��ϵΪb____c����������������������������
�۽�b����Һ���c����Һ�ķ�����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ý�̿������һ����̼��������ijͬѧ�ô�ԭ������ͼװ�ý���ʵ�飬����˵������ȷ����
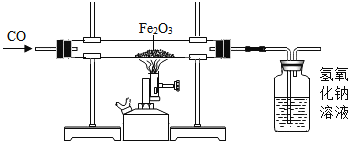
A.�μӷ�Ӧ����������һ����̼������Ϊ40��7
B.�ڸù�����������������ԭ��Ӧ
C.����������Һ�������������������
D.��Ӧ��������δ��Ӧ�����������壬���Բ��ü���ϡ����ķ������ᴿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С�����÷�������Һ�Ʊ�K2SO4����������:
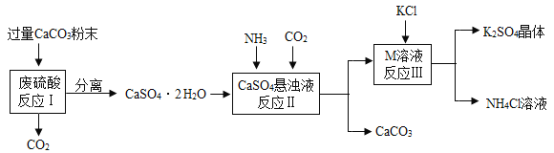
(1)��CaCO3�гɷ�ĩ��Ŀ����___________________��
(2)���������п�ѭ��ʹ�õ�������CO2��__________________(��д��ѧʽ)��
(3)ϴ�ӷ�Ӧ�����þ��岻��ˮ���ñ���K2SO4��Һ��Ŀ��___________________��
(4)���鷴Ӧ�����þ����Ƿ�ϴ�ɾ��ķ�����:ȡ����ϴ��Һ�� �ȼ��������Ba(NO3)2��Һ�������ˣ�������Һ�еμ�_______________�� ���û�а�ɫ������˵��ϴ�Ӹɾ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������кܶ����������ܶ����㷺Ӧ�á�
(1)���ƴ�����ʳ�˵�������е�������_____________________��
(2)����Ʒ������Ʒ���ã���ԭ����____________________��
(3)�ѺϽ���Ϊ���������ܣ����㷺Ӧ��������ҽѧ�����պ���������ѺϽ���ŵ���________________(��дһ��)�����ɽ����ѵ�������________________(������������ԭ��������������) ��
(4)�Ͻ�Mg2Cu��һ��DZ�ڵ�������ϣ�����ʱ����������£���һ�������ȵ�Mg��Cu����������á�
�������Ʊ�Mg2Cu�Ͻ�ʱ��ͨ�������Ŀ����____________________��
�ڽ�11.2g ��Mg2Cu�Ͻ���������ᷴӦ����������������Ϊ___g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��Ļ�ѧѧϰ��ͬѧ���ѳ����˽������������ϵ�൱���У��밴Ҫ������������⣺
��1�������е�����������Ư�ۿ�����ˮ��ɱ��������ij������ȡƯ�۵Ļ�ѧԭ��Ϊ��2X+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O����X�Ļ�ѧʽΪ_____��
��2�������е���Ӫ������ʳƷӪ���뻯ѧ��ϵ���С������������������ӵ�ʳ�������߸�ţ�����е������⡢����ָ_____����������������ԭ��������Ԫ��������
��3�������е�����������ũ������ֲ��ֲ��ҶƬ���ƣ����ҳ����˳溦������Ӧ����ũ��ʩ�ӵĸ��Ϸ�����_____������ţ���
A NH4HCO3 B K2SO4 C KNO3 D Ca��H2PO4��2
��4�������е�������������ϴ�Ӽ���ϴ���ۣ���������ϴ�Ӽ���_____���á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��a��b��c�������ʵ��ܽ��������ͼ��ʾ��
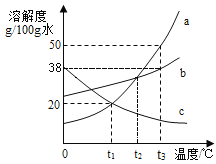
��1���¶���t1��t2֮��ʱ��a��b��c�������ʵ��ܽ�ȴ�С˳����_____������t1��t2�¶ȵ㣩��
��2��t3��ʱ����20��b����50��ˮ�У�������Һ��������������Ϊ_____����ȷ��0.1%����
��3����c�ı�����Һ��Ϊ��������Һ��������_____��
��4����a��b�ı�����Һ��t3�潵��t1�棬���������������ϵ��_____����д��a��b����a��b������ȷ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com