
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
| 取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
| 取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
| 产生气体质量(g) | 0.3 | m | 0.9 | 1.0 | n |
分析 (1)根据取样品都是40g时,硫酸质量是30g时,生成氢气0.3g,硫酸是90g时,生成氢气是0.9g,所以硫酸是60g时,生成氢气是0.6g,硫酸是120g时,生成氢气1.0g,所以硫酸是150g时,生成的氢气也是1.0g进行分析;
(2)根据生成氢气的质量计算出锌的质量,再用铜的质量除以样品的质量乘以百分之百即可.
解答 解:(1)取样品都是40g时,硫酸质量是30g时,生成氢气0.3g,硫酸是90g时,生成氢气是0.9g,所以硫酸是60g时,生成氢气是0.6g,硫酸是120g时,生成氢气1.0g,所以硫酸是150g时,生成的氢气也是1.0g,所以表中m的数值为0.6,n的数值应该为1.0,
故答案为:(1)0.6;1.0;
(2)设锌的质量为 x.
Zn+H2SO4═ZnSO4+H2↑
65 2
x 1g
$\frac{65}{2}=\frac{x}{1g}$
解得:x=32.5g
铜的质量分数为:$\frac{40g-32.5g}{40g}×100%=18.75%$,
答:该黄铜样品中铜的质量分数18.75%.
点评 解答本题关键是要通过图表中数据分析出最多生成氢气1.0g,再利用方程式计算出锌的质量,再进一步进行计算.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:初中化学 来源: 题型:填空题



查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 10:11 | B. | 22:15 | C. | 15:22 | D. | 11:10 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 7 N 氦 14.00 | 8 O 氧 16.00 | 9 F 氟 19.00 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 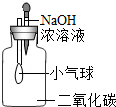 小气球变瘪 | B. |  U型管内液面左高右低 | ||
| C. | 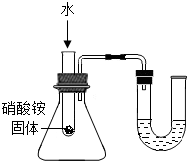 U型管内液面左高右低 | D. | 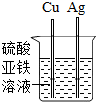 验证铁、铜和银金属活动性强弱 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

| 合金 | 合金的主要性能 | 主要成分及纯金属的性能 |
| 焊锡 | 熔点183℃ | 锡:熔点232℃;铅:熔点327℃. |
| 硬铝 | 强度和硬度好 | 铝、铜、镁等.硬度小,质软. |
| 不锈钢 | 抗腐蚀性好 | 铁、铬、镍等.纯铁抗锈蚀性能不如不锈钢. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com