
| 实验方案 | 实验操作 | 实验现象 | 实验结论 |
| 方案一 | 取适量反应后的溶液于试管中,滴加酚酞溶液后,振荡 | 溶液变红色 | 猜想①正确 |
| 方案二 | 用pH计测得溶液的pH | pH=7 | 猜想②正确 |
| 方案三 | 取锌粒与试管中,加反应后的溶液 | 产生气泡 | 猜想③正确 |
分析 稀盐酸和氢氧化钠反应生成氯化钠和水;
氢氧化钠溶液显碱性,能使酚酞试液变红色;
显中性溶液的pH=7,显酸性溶液pH小于7,显中性和显酸性溶液都不能使酚酞试液变色;
锌能和稀盐酸反应生成氯化锌和氢气.
解答 解:【方案设计】溶液pH=7时,说明稀盐酸和氢氧化钠恰好完全反应,锌和稀盐酸反应生成氯化锌和氢气,实验过程如下表所示:
| 实验方案 | 实验操作 | 实验现象 | 实验结论 |
| 方案一 | 取适量反应后的溶液于试管中,滴加酚酞溶液后,振荡 | 溶液变红色 | 猜想①正确 |
| 方案二 | 用pH计测得溶液的pH | pH=7 | 猜想②正确 |
| 方案三 | 取锌粒与试管中,加反应后的溶液 | 产生气泡 | 猜想③正确 |
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:选择题
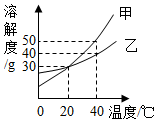 甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法中正确的是( )| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | 40℃时,分别在100g水中加入40g甲、乙,充分溶解后,所得溶液中溶质的质量分数相等 | |
| C. | 20℃时,甲物质和乙物质的溶液中溶质的质量分数一定相等 | |
| D. | 分别将40℃的甲物质和乙物质的饱和溶液降温到20℃,甲析出晶体量一定大于乙 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 试验方法 | 可能观察到的现象 | 结论 |
| 将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中. | 如果产生气泡 | 则盐酸过量 |
| 如果不产生气泡 | 则盐酸与氢氧化钠恰好完全反应 |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 表示分子个数的是⑦ | |
| B. | 表示离子所带电荷数的是②⑤ | |
| C. | 表示化合价数值的是④ | |
| D. | 表示一个分子中含有某种原子个数的是①③⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com