
【题目】为测定某稀盐酸溶质的质量分数,取100g该溶液于烧杯中,向烧杯中滴入16%的NaOH溶液,用pH计测得滴入NaOH溶液质量与pH的关系如下图所示。
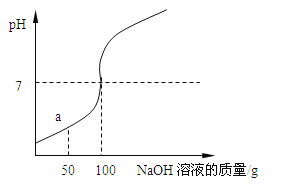
(1)在a点时,烧杯中溶液的溶质是__________,此时向溶液中滴入紫色石蕊试液,溶液呈____色。
(2)通过计算求盐酸溶液溶质的质量分数。___________
(3)若改用16%的氢氧化钾溶液来测定盐酸溶质的质量分数,当滴入KOH溶液的质量为100g时,溶液的pH____7(填“大于”、“小于”或“等于”)。
【答案】HCl、NaCl 红 14.6% 小于
【解析】
(1)由图示可知,滴加氢氧化钠溶液到100克时,氢氧化钠溶液与稀盐酸完全反应,当滴加稀盐酸至图中a点时,稀盐酸还没有完全反应,这时溶液中的溶质就有氯化钠和氯化氢两种。
(2)根据参加反应的氢氧化钠溶液的质量,利用化学方程式求出参加反应的盐酸中溶质的质量,进而求出盐酸的质量分数。
(3)欲正确解答本题,需根据NaOH和KOH的相对分子质量判断反应后溶液的酸碱性。
(1)由图示可知,滴加氢氧化钠溶液到100克时,氢氧化钠溶液与稀盐酸完全反应,当滴加稀盐酸至图中a点时,稀盐酸还没有完全反应,盐酸就有剩余,此时溶液中的溶质有NaCl和HCl;此时溶液呈酸性,向溶液中滴入石蕊,溶液显红色。
(2)设100g稀盐酸中含HCl的质量为x。

![]()
解得x=14.6g
所用稀盐酸的溶质质量分数=![]()
(3)NaOH的相对分子质量比KOH小,故等质量的NaOH和KOH比,氢氧化钠溶液中OH-的个数更多,故用16%的氢氧化钾溶液100克不能完全中和盐酸,反应后盐酸有剩余,溶液呈酸性,pH小于7。


科目:初中化学 来源: 题型:
【题目】轻质碳酸钙可用作牙膏摩擦剂。工业上常用石灰石(含有少量杂质)来制备比较纯净的轻质碳酸钙。
已知:①石灰石高温煅烧可以生成生石灰和二氧化碳,此外还有少量不反应的杂质剩余。②生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆。
某实验小组同学设计了2种转化流程,如下图所示。

请回答下列问题:
(1)石灰石高温煅烧反应的化学方程式是_____。
(2)物质C为_____,据你分析加水时沉淀池的温度会_____。(“升高”“降低”“不变”)
(3)反应④的化学方程式是_____。
(4)操作Ⅱ应采用的方法是_____。
(5)采用反应①②③制备轻质碳酸钙的方法优点有(写出一种即可)_____;采用反应①②④制备轻质碳酸钙的方法优点有(写出一种即可)_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图。下列说法正确的是
![]()
A. 反应前后,碳和氮的化合价发生了改变
B. 生成的丙和丁的分子个数比为1∶1
C. 反应前后,元素的种类没有改变,原子的个数发生了变化
D. 乙和丙的元素组成相同,所以它们的化学性质相同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如下实验。已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
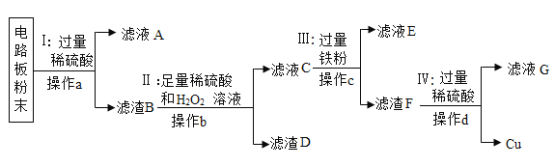
(1)将电路板粉碎成粉末的目的是_____。
(2)滤液A中的溶质除硫酸外,还有_____。
(3)步骤Ⅱ中的实验现象是:固体部分溶解,_____。
(4)上述步骤_____(选填步骤编号)所包含的反应体现铁的活动性比铜强。
(5)步骤IV中反应的化学方程式是_____;判断步骤Ⅳ中加入的稀硫酸过量的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小丽用图所示装置进行实验.
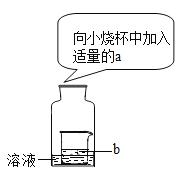
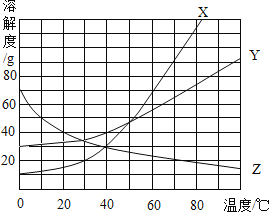
①若广口瓶内盛有70oC的X物质的饱和溶液,b中是水,当a是下列___(填字母)物质时,X物质的饱和溶液有望变成不饱和溶液.
A 浓硫酸 B 硝酸铵 C 氢氧化钠溶液 D 氢氧化钙溶液
②若广口瓶内盛有10C的Z物质的饱和溶液,a是镁条和b中是稀硫酸,观察到的现象是(Z与其它物质不反应)___、___.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】自来水消毒过程中常发生下列转化。其中说法正确的是
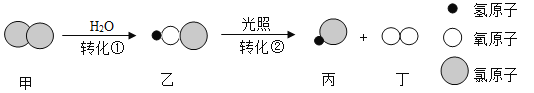
A.转化过程中有两种氧化物
B.转化①所得溶液pH >7
C.转化②中丙和丁的分子个数之比为1∶1
D.转化①、②中氯元素的化合价都发生变化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】深圳是一座美丽的滨海城市,海洋资源非常丰富。如图为海水中富含的钠元素和氯元素在元素周期表中的部分信息,下列有关说法不正确的是( )

A.钠是一种金属元素
B.钠的相对原子质量是22.99g
C.钠原子的质子数为11
D.氯元素的原子序数为17
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有一定质量稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算:
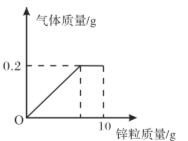
(1)稀硫酸反应完时,产生氢气的质量为 g,消耗锌粒质量为 g。
(2)该稀硫酸中溶质的质量分数(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质。(如图所示,连线表示相互反应)。
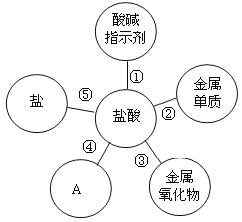
(1)图中A所代表的物质类别是_______________。
(2)为了验证性质③,可选用的物质是___________(填一种即可)。
(3)镁和锌可以用来验证盐酸的性质②,小红要探究镁和锌与盐酸反应的快慢,需要控制不变(相同)的量是_______________(填序号)。
A 两种金属的大小
B 盐酸的质量分数
C 反应容器的大小
D 温度
(4)如用湿润的pH试纸测定盐酸的pH,则结果会____________(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com