
| A. | 电视机等电器着火用水扑灭 | |
| B. | 夜晚打开厨房中的电灯检查液化气罐是否漏气 | |
| C. | 油锅着火可用锅盖盖灭 | |
| D. | 高楼住宅发生火灾,可使用楼内电梯逃生 |
分析 根据灭火的原理:(1)清除可燃物或使可燃物与其他物品隔离,(2)隔绝氧气或空气,(3)使温度降到可燃物的着火点以下;根据日常经验和燃烧的物质的性质作出正确的判断:电器着火不能用水、室内起火不能通风来解答本题.
解答 解:A、电器着火若用水扑灭极易造成电线短路和人体触电,电器着火应先切断电源,再灭火;故错误;
B、打开厨房中的电灯检查液化气罐是否漏气极易引燃液化气而发生火灾或爆炸;故错误;
C、用锅盖盖灭,隔绝了氧气使油熄灭;故正确;
D、高楼发生火灾时,线路容易被烧毁或断电,乘电梯易发生触电,停电电梯便会停在楼层中间;电梯厢高温时变形容易失控甚至变形卡住,电梯运作时会使电梯竖井失去防烟功能,从而产生烟囱效应,使其成为拔烟助火的垂直通道,既会威胁人员的安全,又助长了烟火的扩散与蔓延等.所以,在发生火灾时,不能乘坐电梯逃生,错误.
故选:C.
点评 本题考查了根据灭火原理的知识和燃烧特殊物质的性质特点,采用不同的灭火方法进行灭火,考察了学生灵活运用知识解决生活问题的能力.


科目:初中化学 来源: 题型:解答题
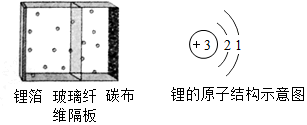 2017年4月长春应用化学研究所提出了一种独特的锂-氮电池(LI-N2),结构示意图见左图,该电池由锂箔作负极,多孔碳布作正极,玻璃纤维作隔板,可以直接利用空气中的氮气,锂-氮电池的反应方程式:6Li+N2=2Li3N.请回答:
2017年4月长春应用化学研究所提出了一种独特的锂-氮电池(LI-N2),结构示意图见左图,该电池由锂箔作负极,多孔碳布作正极,玻璃纤维作隔板,可以直接利用空气中的氮气,锂-氮电池的反应方程式:6Li+N2=2Li3N.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 错误实例 | 错误分析 |
| A | 铁与稀硫酸生成硫酸铁 | 反应产物不正确 |
| B | FeCl3+3NaOH═Fe(OH)3+NaCl | 只缺少沉淀符号 |
| C | 2KMnO4═K2MnO4+MnO2+O2↑ | 反应条件不正确 |
| D | 氢氧化钠俗名烧碱或纯碱 | 俗名中的纯碱不正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3 | B. | 2HCl+Ca(OH)2═CaCl2+2H2O | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
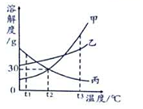
| A. | t1℃时,等质量的甲、乙溶液中所含溶质的质量为甲>乙 | |
| B. | t2℃时,20g丙能溶解于50g水中形成70g溶液 | |
| C. | 若要将甲从混有少量乙的溶液,可采取蒸发溶剂的方法 | |
| D. | t3℃时,将甲、乙、丙三种物质的饱和溶液降温至t2℃,所得溶液溶质质量分数的大小关系为乙>甲>丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com