
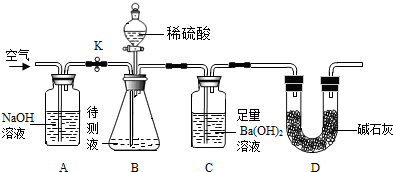
| 44 |
| 197 |
| x |
| 0.394g |
| 0.088g |
| 0.05L |


科目:初中化学 来源: 题型:
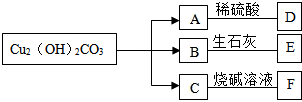 铜制品久置在潮湿的空气中表面会有绿点出现,其主要成分铜绿[Cu2(OH)2CO3]受热分解生成三种氧化物.现有如图所示的转化关系(部分生成物已略去).
铜制品久置在潮湿的空气中表面会有绿点出现,其主要成分铜绿[Cu2(OH)2CO3]受热分解生成三种氧化物.现有如图所示的转化关系(部分生成物已略去).查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| A、绿原酸属于混合物 |
| B、绿原酸由碳、氢、氧三种元素组成 |
| C、绿原酸的相对分子质量为354 g |
| D、绿原酸中碳、氢元素的质量比为16:18 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
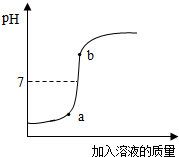 实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.
实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.查看答案和解析>>
科目:初中化学 来源: 题型:
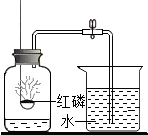 红磷燃烧除需要氧气外,还需要满足的条件是什么?
红磷燃烧除需要氧气外,还需要满足的条件是什么?查看答案和解析>>
科目:初中化学 来源: 题型:
 甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题.
甲和乙两种白色固体在不同温度时的溶解度如表所示,请回答下列问题.| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | 甲 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| 乙 | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com