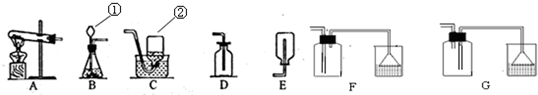
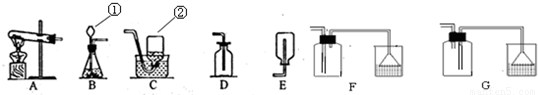
解:(1)仪器的名称①长颈漏斗;②集气瓶;
(2)由化合物中各元素的代数和为0以及氢元素的化合价为+1,可知H
2S气体中的硫元素的化合价为-2价;硫化亚铁(化学式为FeS)固体和稀硫酸在常温下反应生成硫化氢气体和硫酸亚铁,化学方程式FeS+H
2SO
4=FeSO
4+H
2S↑,该反应是两种化合物相互交换成分生成另外两种化合物,属于复分解反应;反应物的状态为固体和液体,反应条件为常温,所以发生装置选择B;硫化氢气体有剧毒,密度比空气大,能溶于水,所以收集装置选择F;溶于水后呈酸性可以用氢氧化钠溶液吸收;
(3)闻到一股烧焦羽毛气味,说明内膜有蛋白质;碳酸钙高温煅烧生成氧化钙和水,化学反应方程式为CaCO
3
CaO+CO
2↑;氧化钙和水反应生成氢氧化钙,氢氧化钙溶于水显碱性,能使无色酚酞试液变为红色,化学反应方程式为:CaO+H
2O=Ca(OH)
2;
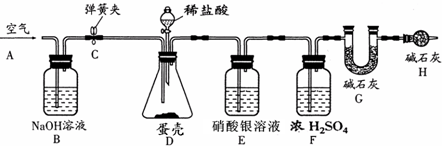
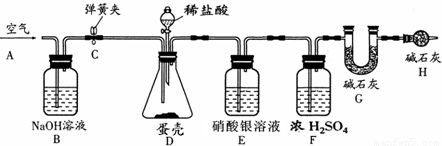
(4)空气中含有二氧化碳,所以实验前先把锥形瓶内的二氧化碳除掉,加入样品前还应从导管A处缓缓鼓入空气;盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,化学反应方程式为CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;盐酸具有挥发性,盐酸和硝酸银反应,所以装置E的作用是吸收氯化氢气体;反应结束后打开弹簧夹C,缓缓鼓入空气的目的是把生成二氧化碳全部进入到G装置中;装置B的作用是:吸收空气中二氧化碳;若缺少H装置,空气中的二氧化碳和水会进入,使得装置G的质量增大,则测得的碳酸钙的质量分数将偏大;
设蛋壳中碳酸钙的质量为x,
装置G增加的质量就是二氧化碳的质量=52.64g-50.00g=2.64g
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
x 2.64g

x=6.00g
则碳酸钙的质量分数=

=60%
答:碳酸钙的质量分数为60%.
(5)因碳酸钙与酸反应,则残渣质量为4.30g,碳酸钙的质量为10.00g-4.30g=5.70g
则碳酸钙的质量分数=

=57%
答:碳酸钙的质量分数为57%.
小刚认为小勇的实验过程有一个明显的缺陷会导致测得的碳酸钙的含量偏低,这个缺陷是残渣质量未洗涤直接烘干就称量造成结果偏大,从而使得碳酸钙的含量偏低.
故答案为:(1)①长颈漏斗;②集气瓶;
(2)-2;FeS+H
2SO
4=FeSO
4+H
2S↑;复分解;B;F;氢氧化钠;
(3)蛋白质;CaCO
3
CaO+CO
2↑;红;CaO+H
2O=Ca(OH)
2;
(4)从导管A处缓缓鼓入空气;CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;吸收氯化氢气体;生成二氧化碳全部进入到G装置中;吸收空气中二氧化碳;大;60%;
(5)57%;未洗涤直接烘干就称量造成结果偏大,从而使得碳酸钙的含量偏低.
分析:(1)根据常见仪器的名称进行解答;
(2)根据化合物中各元素的代数和为0以及氢元素的化合价为+1求出H
2S气体中的硫元素的化合价;硫化亚铁(化学式为FeS)固体和稀硫酸在常温下反应生成硫化氢气体和硫酸亚铁;反应物的状态和反应条件选择发生装置;气体的性质选择收集装置以及溶于水后呈酸性可以用碱液吸收进行解答;
(3)根据闻到一股烧焦羽毛气味,说明内膜有蛋白质;碳酸钙高温煅烧生成氧化钙和水;氧化钙和水反应生成氢氧化钙,氢氧化钙溶于水显碱性,能使无色酚酞试液变为红色进行解答;
(4)根据空气中含有二氧化碳,所以实验前先把锥形瓶内的二氧化碳除掉;盐酸和碳酸钙反应生成氯化钙、水和二氧化碳;盐酸具有挥发性以及盐酸和硝酸银反应;反应结束后打开弹簧夹C,缓缓鼓入空气的目的是把生成二氧化碳全部进入到G装置中;若缺少H装置,空气中的二氧化碳和水会进入,使得装置G的质量增大;根据装置G增加的质量就是二氧化碳的质量求出实验测得蛋壳中碳酸钙的质量进而求出碳酸钙的质量分数;
(5)根据鸡蛋壳的主要成分是碳酸钙,与酸反应后蛋壳残渣质量为4.3g,因碳酸钙能与酸反应,则可计算碳酸钙的质量,再计算蛋壳中碳酸钙的质量分数.
点评:掌握发生装置和收集装置的选择条件,同时记住一些除杂的方法.综合性比较强.经常出现在实验题中,同学们要认真掌握.

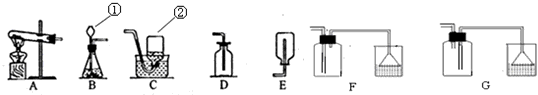


 CaO+CO2↑;氧化钙和水反应生成氢氧化钙,氢氧化钙溶于水显碱性,能使无色酚酞试液变为红色,化学反应方程式为:CaO+H2O=Ca(OH)2;
CaO+CO2↑;氧化钙和水反应生成氢氧化钙,氢氧化钙溶于水显碱性,能使无色酚酞试液变为红色,化学反应方程式为:CaO+H2O=Ca(OH)2;
 =60%
=60% =57%
=57% CaO+CO2↑;红;CaO+H2O=Ca(OH)2;
CaO+CO2↑;红;CaO+H2O=Ca(OH)2;