
【题目】化学与生活密切相关。
Ⅰ.在“①稀硫酸、②水、③熟石灰、④酒精、⑤氯化钾、⑥铁粉”中,请选择适当物质的序号填空:
(1)用于改良酸性土壤的是____________, (2)用于清除铁锈的是_________,
(3)实验室常用的液体燃料是____________, (4)最常见的溶剂____________,
(5)用于防止食物变质的双吸剂____________, (6)可作钾肥的是____________。
Ⅱ.合现有下列五种物质A. 食盐 B. 小苏打 C. 苹果 D. 葡萄糖 E. 维生素A
请按下列要求填空(填序号)。
富含维生素C的是___________;可直接进入血液,补充能量的是________;既可作为疏松剂,又可治疗胃酸过多的是________;食用过多会引起血压升高的________;夜盲症患者可以在医生的指导下补充大量________进行治疗。
Ⅲ.材料是人类生产和生活的物质基础,合理使用材料可以改善我们的生活。
(1)钢铁的生产与使用是人类文明和生活进步的一个重要标志。
①工业上用赤铁矿炼铁的主要化学反应方程式:_______________________________,实验室完成此实验是要注意先____________再___________,目的是为了_____________ 。
②我们还可以采用湿法冶金获得金属,请写出铁与硫酸铜溶液反应的化学方程式: ______________。
③ 炒过菜的铁锅未及时洗净擦干,第二天便会因腐蚀出现红褐色锈斑。铁锅的腐蚀主要是铁与_______和_______反应造成,铁锈的主要成分是________。为防止铁制品锈蚀,可采取的方法有_____________(只需填写一种即可)。
(2) 体育场馆建设需大量建筑材料。下列材料属于复合材料的是________(填字母) ,属于合成材料的是________(填字母)。
a. 石灰石 b. 玻璃钢 c. 玻璃 d 钢筋混凝土 e 聚氯乙烯塑料
Ⅳ.化学的发展为人类解决能源危机带来了曙光。
(1)化学电池是一种高效利用能源的装置,电池在使用时将_______能转化为_______能
(2)下图是某电池的内部结构示意图,
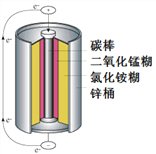
①其中正极为_______,负极为_______。
②请写出用二氧化锰和双氧水混合制取氧气的化学方程式__________________。
③电池材料中的糊状电解质中含有淀粉,我们可以用________(填试剂名称)来检验,检验时课观察到__________________。
④电解液中的氯化铵,再农业生产中可做______肥,施用时要注意__________________。
【答案】 ③ ① ④ ② ⑥ ⑤ C D B A E 3CO+Fe2O3![]() 2Fe+3CO2 通入一氧化碳 高温加热 排尽空气防止爆炸 Fe+CuSO4==Cu+FeSO4 氧气 水 Fe2O3 涂保护膜 bd e 化学 电 碳(棒) 锌(筒) 2H2O2
2Fe+3CO2 通入一氧化碳 高温加热 排尽空气防止爆炸 Fe+CuSO4==Cu+FeSO4 氧气 水 Fe2O3 涂保护膜 bd e 化学 电 碳(棒) 锌(筒) 2H2O2![]() 2H2O + O2↑ 碘水(碘酒) 碘水(或碘酒)变蓝 氮 避免与碱性物质物质混用
2H2O + O2↑ 碘水(碘酒) 碘水(或碘酒)变蓝 氮 避免与碱性物质物质混用
【解析】Ⅰ.(1)用于改良酸性土壤的是熟石灰;(2)用于清除铁锈的是稀硫酸;(3)实验室常用的液体燃料是酒精; (4)水是最常见的溶剂;(5)铁粉用于防止食物变质的双吸剂; (6)可作钾肥的是氯化钾;Ⅱ.富含维生素C的是 苹果;可直接进入血液,补充能量的是葡萄糖;既可作为疏松剂,又可治疗胃酸过多的是小苏打;食用食盐过多会引起血压升高;绝少维生素A可导致夜盲症患;Ⅲ.①工业上用赤铁矿炼铁的主要化学反应方程式为:3CO+Fe2O3![]() 2Fe+3CO2,实验室完成此实验是要注意先通入一氧化碳再加热赤铁矿,目的是为了排尽空气防止爆炸;②铁与硫酸铜溶液反应的化学方程式为:Fe+CuSO4=Cu+FeSO4;③ 铁锅的腐蚀主要是铁与水和氧气反应造成,铁锈的主要成分是氧化铁;为防止铁制品锈蚀,可采取的方法有涂油、刷漆、涂保护膜等;(2)a. 石灰石属于无机非金属材料;b. 玻璃钢是在塑料中嵌入玻璃丝,属于复合材料;c. 玻璃属于无机非金属材料;d.钢筋混凝土是由钢材、水泥等材料制成的,属于复合材料;e.聚氯乙烯塑料属于合成材料。Ⅳ.(1)化学电池是将化学能转化为电能;(2)据图电池的内部结构示意图,可知①其中正极为碳棒,负极为 锌筒;②二氧化锰和双氧水混合制取氧气的化学方程式:2H2O2
2Fe+3CO2,实验室完成此实验是要注意先通入一氧化碳再加热赤铁矿,目的是为了排尽空气防止爆炸;②铁与硫酸铜溶液反应的化学方程式为:Fe+CuSO4=Cu+FeSO4;③ 铁锅的腐蚀主要是铁与水和氧气反应造成,铁锈的主要成分是氧化铁;为防止铁制品锈蚀,可采取的方法有涂油、刷漆、涂保护膜等;(2)a. 石灰石属于无机非金属材料;b. 玻璃钢是在塑料中嵌入玻璃丝,属于复合材料;c. 玻璃属于无机非金属材料;d.钢筋混凝土是由钢材、水泥等材料制成的,属于复合材料;e.聚氯乙烯塑料属于合成材料。Ⅳ.(1)化学电池是将化学能转化为电能;(2)据图电池的内部结构示意图,可知①其中正极为碳棒,负极为 锌筒;②二氧化锰和双氧水混合制取氧气的化学方程式:2H2O2![]() 2H2O + O2↑;③淀粉遇到碘酒变蓝;④氯化铵中含有铵根,属于氮肥,施用时要注意避免与碱性物质物质混用,否则降低肥效。
2H2O + O2↑;③淀粉遇到碘酒变蓝;④氯化铵中含有铵根,属于氮肥,施用时要注意避免与碱性物质物质混用,否则降低肥效。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】为除去粗盐中含有的氯化镁、硫酸钠、氯化钙等杂质,应加入过量的氢氧化钠、氯化钡、碳酸钠等物质,将杂质转化为沉淀。过滤去除沉淀后,再向滤液中加入适量的盐酸得到精盐水。实验操作过程如下图所示:
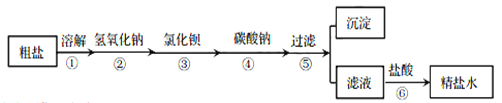
下列说法错误的是
A. 实验操作步骤也可以是①③④②⑤⑥
B. 操作⑥中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH 调为7
C. 在实验操作过程中,氯化钡和碳酸钠溶液的添加顺序不可以颠倒
D. 操作⑤得到的沉淀中共有三种物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验是进行科学探究的重要方式。
(1)根据下图回答问题。
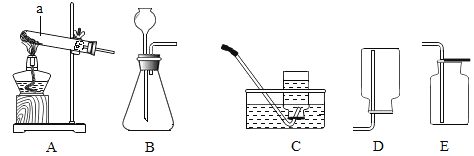
①装置中标“a”的仪器名称是______;②实验室制备、收集二氧化碳选用的装置为______(填序号);③实验室用高锰酸钾制取氧气的化学方程式为___。
(2)下面装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。
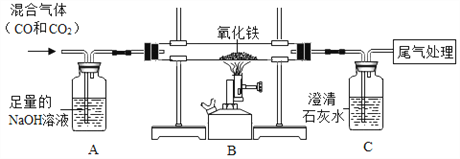
①B装置玻璃管里可观察到的现象是_________;反应的化学方程式为:_____________②C装置中反应的化学方程式为:__________。
(3)某同学在探究中和反应实验时设计如下方案:将适量稀盐酸倒入锥形瓶中,滴入酚酞溶液后,慢慢滴加氢氧化钠溶液并不断搅拌,通过溶液刚刚变红来判断中和反应恰好完成。请分析上述方案是否合理并说明理由。___________
(4)将一定质量的NaHCO3溶液与100g稀盐酸混合,二者恰好完全反应,溶液的总质量减少8.8g。求:稀盐酸中溶质的质量分数为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,生活实际中经常要处理工厂排放的废水,中和反应应用广泛。
(1)某同学将氢氧化钠固体放入盛有稀硫酸的试管中并振荡,试管壁发烫,得出中和反应放热。但该结论不合理,理由是___________ 。
(2)改进实验:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,烧杯内溶液温度变化如图1:
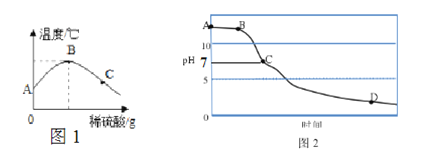
①由图1可知,中和反应是 ______(填“放热”或“吸热”)反应,图1中B点表示的含义是_________。
②用pH传感器测得烧杯中溶液的pH随滴加液体与时间的变化曲线如图2,图中B、C、D所对应溶液中所含溶质硫酸钠的质量大小关系有 ______________。
(3)若一定体积的废水中含有0.01mol氢氧化钠,中和这些碱,需要________mol的硫酸?(例式计算)
(4)而将稀硫酸滴入氢氧化钠溶液中,有气泡产生,可能是氢氧化钠溶液已变质。分析变质的原因_______________________________(用化学方程式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C为初中化学常见的物质,且都含有同一种元素,它们之间的反应关系如下(→表示一步反应的转化):
![]()
(1)若A、B组成元素相同,B含量过多导致温室效应加剧,写出一个符合B→C的化学方程式:_____。
(2)若B位密度最小的气体,A、C的化学式可以是_______(填序号)
①HCl、H2O ②H2SO4、NaOH ③H2O2、H2CO3
(3)若A、B、C是不同类型的化合物,B是改良酸性土壤的碱,B→C发生中和反应,则A可以是____,写出B→C的化学方程式:_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钛(Ti)被称为“21世纪的金属”。
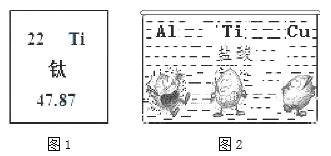
(1)图1是钛元素在周期表中的信息,其核内质子数为___________。
(2)图2是Ti、Al、Cu三种金属在稀盐酸里的反应现象,则这三种金属的活动性由大到小的顺序是___。
(3)下图是利用钛白粉(TiO2)生产海绵钛(Ti)的工艺流程:
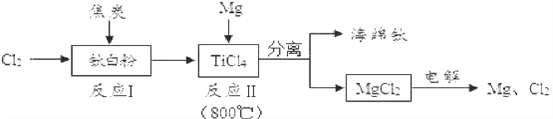
①反应Ⅰ的化学方程式为:2Cl2+TiO2+2C TiCl4+2X,则X的化学式为_____________。
②反应Ⅱ的化学方程式是______________。
③该工艺流程中,可以循环使用的物质 有镁和___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学反应过程的微观示意图如下:
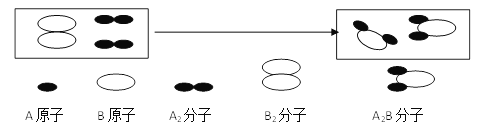
下列说法错误的是
A. 原子是化学变化中的最小粒子
B. 上述反应的化学方程式可表示为:4A + 2B = 2A2B
C. 在化学变化中分子分成原子,原子又重新组合成新物质的分子
D. 元素的种类、原子的数目在化学变化前后不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置图,按要求回答下列问题:
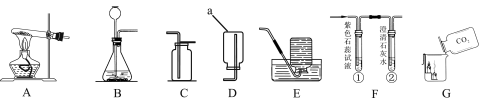
(1)仪器a的名称是 。
(2)实验室用高锰酸钾制取氧气,反应的化学方程式是 ,应选用的发生和收集装置是 (填字母序号)。
(3)小明同学用F装置验证二氧化碳的性质,当通入二氧化碳一段时间后,试管①中产生的现象是 ;试管②中的澄清石灰水变浑浊,反应的化学方程式是 。G中观察到蜡烛由低到高依次熄灭,说明二氧化碳具有的性质是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碱式碳酸镁是白色粉末,不溶于水,可用于镁盐制备、制药工业等,其组成一般以xMgCO3yMg(OH)2zH2O 表示。某化学兴趣小组同学在老师带领下参观了碱式碳酸镁的生产流程,并设计实验确定碱式碳酸镁的组成。
Ⅰ 碱式碳酸镁的制备
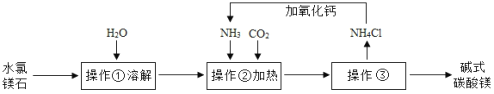
(1)操作③的名称是__________。
(2)上述流程中NH3被循环使用,流程中生成NH3的化学方程式为:①CaO+H2O═Ca(OH)2;②_______。
(3)判断碱式碳酸镁是否洗涤干净,可向最后的洗出液中滴加_______(填字母),观察现象判断。
A.盐酸和氯化钡的混合液 B.硝酸和硝酸银的混合液 C.碳酸钠溶液 D.稀盐酸
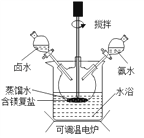
(4)实验室可用复盐 MgCO3 (NH4)2CO3H2O 作原料制备碱式碳酸镁。取一定量原料放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如下图所示),加入一定量蒸馏水,开启搅拌器同时加入预定的氨水,待温度达40℃时滴加卤水并继续滴入氨水,一段时间后通过系列实验操作得到碱式碳酸镁产品。实验中搅拌的目的是_________,水浴加热的优点是 ________ 。
Ⅱ 测定碱式碳酸镁的组成
【查阅资料】
①MgCO3![]() MgO+CO2↑。② Mg(OH)2
MgO+CO2↑。② Mg(OH)2![]() MgO+H2O。
MgO+H2O。
【实验设计】
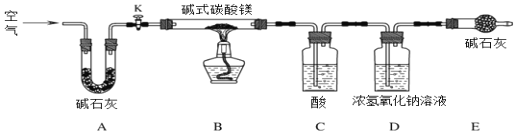
⑸ C中的物质是_________(填名称)。实验过程中,当关闭K后,加热B装置,判断碱式碳酸镁完全分解的方法是:当观察到C中_________,则其已完全分解。D处常用浓氢氧化钠溶液而不用饱和石灰水的原因是____________。
【数据分析】
(6)取碱式碳酸镁[xMgCO3yMg(OH)2zH2O]4.66g,高温煅烧至恒重,得到固体2.00g, CO21.76g,试通过计算确定该碱式碳酸镁中 x:y 的最简整数比________(请写出计算过程)。
(7)若没有 A 装置,则测定得到的z值__________ (填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com