
【题目】碱式碳酸镁是白色粉末,不溶于水,可用于镁盐制备、制药工业等,其组成一般以xMgCO3yMg(OH)2zH2O 表示。某化学兴趣小组同学在老师带领下参观了碱式碳酸镁的生产流程,并设计实验确定碱式碳酸镁的组成。
Ⅰ 碱式碳酸镁的制备
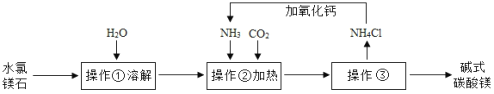
(1)操作③的名称是__________。
(2)上述流程中NH3被循环使用,流程中生成NH3的化学方程式为:①CaO+H2O═Ca(OH)2;②_______。
(3)判断碱式碳酸镁是否洗涤干净,可向最后的洗出液中滴加_______(填字母),观察现象判断。
A.盐酸和氯化钡的混合液 B.硝酸和硝酸银的混合液 C.碳酸钠溶液 D.稀盐酸
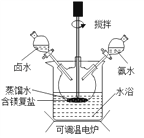
(4)实验室可用复盐 MgCO3 (NH4)2CO3H2O 作原料制备碱式碳酸镁。取一定量原料放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如下图所示),加入一定量蒸馏水,开启搅拌器同时加入预定的氨水,待温度达40℃时滴加卤水并继续滴入氨水,一段时间后通过系列实验操作得到碱式碳酸镁产品。实验中搅拌的目的是_________,水浴加热的优点是 ________ 。
Ⅱ 测定碱式碳酸镁的组成
【查阅资料】
①MgCO3![]() MgO+CO2↑。② Mg(OH)2
MgO+CO2↑。② Mg(OH)2![]() MgO+H2O。
MgO+H2O。
【实验设计】
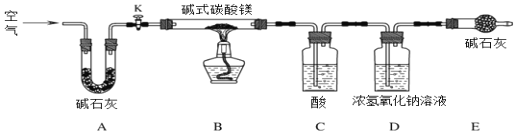
⑸ C中的物质是_________(填名称)。实验过程中,当关闭K后,加热B装置,判断碱式碳酸镁完全分解的方法是:当观察到C中_________,则其已完全分解。D处常用浓氢氧化钠溶液而不用饱和石灰水的原因是____________。
【数据分析】
(6)取碱式碳酸镁[xMgCO3yMg(OH)2zH2O]4.66g,高温煅烧至恒重,得到固体2.00g, CO21.76g,试通过计算确定该碱式碳酸镁中 x:y 的最简整数比________(请写出计算过程)。
(7)若没有 A 装置,则测定得到的z值__________ (填“偏大”、“偏小”、“无影响”)。
【答案】 过滤 ![]() B 反应物充分混合接触,提高反应速率 反应物均匀受热 浓硫酸 无气泡产生 等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳 4∶1 偏大
B 反应物充分混合接触,提高反应速率 反应物均匀受热 浓硫酸 无气泡产生 等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳 4∶1 偏大
【解析】本题考查了物质的相互转化和制备,常见气体的检验与除杂方法,盐的化学性质和化学方程式的书写。
(1)操作③是把液体和固体分离,所以操作③的名称是过滤;
(2)上述流程中,氯化铵和氢氧化钙反应生成氯化钙、水和氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(3)碱式碳酸镁洗涤干净的标志是最后的洗出液中不含有NH4Cl。判断碱式碳酸镁是否洗涤干净,可向最后的洗出液中滴加硝酸和硝酸银的混合液,如果不产生白色沉淀,说明已经洗涤干净。故选B。
(4)实验中搅拌的目的是使反应物充分混合接触,提高反应速率;水浴加热的优点是反应物受热均匀;
(5)C 中的物质用来吸收水蒸气,所以是浓硫酸;
实验过程中,当关闭 K 后,加热B装置,判断碱式碳酸镁完全分解的方法是:当观察到C中无气泡产生,则其已完全分解;
D处常用浓氢氧化钠溶液 而不用饱和石灰水的原因是等体积的浓氢氧化钠溶液比饱和石灰水含有更多的溶质,能充分吸收二氧化碳。
(6)设碱式碳酸镁中碳酸镁质量为x,生成氧化镁质量为y,
MgCO3![]() MgO+CO2↑
MgO+CO2↑
84 40 44
x y 1.76g
![]() x=3.36g
x=3.36g
![]() y=1.6g
y=1.6g
设碱式碳酸镁中氢氧化镁质量为a,
碱式碳酸镁分解生成氧化镁质量为:2.00g﹣1.6g=0.4g,
Mg(OH)2![]() MgO+H2O,
MgO+H2O,
58 40
a 0.4g
![]() a=0.58g,
a=0.58g,
84x:58y=3.36g:0.58g x:y=4:1,
答:该碱式碳酸镁中 x:y 的最简整数比是4:1。
(7)若没有 A 装置,空气中的水蒸气会进入C装置中,则会导致反应生成的水偏大,从而导致测定得到的z值偏大。


科目:初中化学 来源: 题型:
【题目】化学与生活密切相关。
Ⅰ.在“①稀硫酸、②水、③熟石灰、④酒精、⑤氯化钾、⑥铁粉”中,请选择适当物质的序号填空:
(1)用于改良酸性土壤的是____________, (2)用于清除铁锈的是_________,
(3)实验室常用的液体燃料是____________, (4)最常见的溶剂____________,
(5)用于防止食物变质的双吸剂____________, (6)可作钾肥的是____________。
Ⅱ.合现有下列五种物质A. 食盐 B. 小苏打 C. 苹果 D. 葡萄糖 E. 维生素A
请按下列要求填空(填序号)。
富含维生素C的是___________;可直接进入血液,补充能量的是________;既可作为疏松剂,又可治疗胃酸过多的是________;食用过多会引起血压升高的________;夜盲症患者可以在医生的指导下补充大量________进行治疗。
Ⅲ.材料是人类生产和生活的物质基础,合理使用材料可以改善我们的生活。
(1)钢铁的生产与使用是人类文明和生活进步的一个重要标志。
①工业上用赤铁矿炼铁的主要化学反应方程式:_______________________________,实验室完成此实验是要注意先____________再___________,目的是为了_____________ 。
②我们还可以采用湿法冶金获得金属,请写出铁与硫酸铜溶液反应的化学方程式: ______________。
③ 炒过菜的铁锅未及时洗净擦干,第二天便会因腐蚀出现红褐色锈斑。铁锅的腐蚀主要是铁与_______和_______反应造成,铁锈的主要成分是________。为防止铁制品锈蚀,可采取的方法有_____________(只需填写一种即可)。
(2) 体育场馆建设需大量建筑材料。下列材料属于复合材料的是________(填字母) ,属于合成材料的是________(填字母)。
a. 石灰石 b. 玻璃钢 c. 玻璃 d 钢筋混凝土 e 聚氯乙烯塑料
Ⅳ.化学的发展为人类解决能源危机带来了曙光。
(1)化学电池是一种高效利用能源的装置,电池在使用时将_______能转化为_______能
(2)下图是某电池的内部结构示意图,
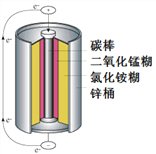
①其中正极为_______,负极为_______。
②请写出用二氧化锰和双氧水混合制取氧气的化学方程式__________________。
③电池材料中的糊状电解质中含有淀粉,我们可以用________(填试剂名称)来检验,检验时课观察到__________________。
④电解液中的氯化铵,再农业生产中可做______肥,施用时要注意__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2022年第24届冬季奥运会将在北京市和张家口市联合举行。如图所示,“五环”中相交两环中的物质间能够发生化学反应。
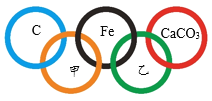
(1)“五环”中已有的3种物质中,属于化合物的是_________。
(2)甲、乙分别是O2、Fe2O3、稀盐酸、Ca(OH)2四种物质中的一种,其中,C与甲反应的现象为_________,物质乙为__________。
(3)“五环”中的物质Fe可以替换成__________(填一种即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】家庭中长期使用的热水壶底部有一层水垢,主要成分是碳酸钙和氢氧化镁,可用酸溶液来清除水垢。小明同学想通过实验测定水垢中碳酸钙的含量,他将过量的稀盐酸加入到200 g水垢中(假定水垢中杂质不与酸反应),并将产生的CO2气体全部通入到足量的NaOH溶液中(不考虑盐酸的挥发性),NaOH溶液增加的质量与反应时间的关系如图所示,
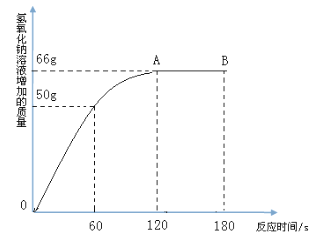
试根据题意回答下列问题:
(1)在滴入稀盐酸的过程中,观察到的一项明显现象是_______________。
(2)计算水垢中碳酸钙的质量分数是___________________(写出相应的计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一包白色固体可能含有 Ba(NO3)2、NaCl、NaOH、Na2SO4、CuSO4 中的一种或几种。为确定其组成,某同学设计了如下实验方案:
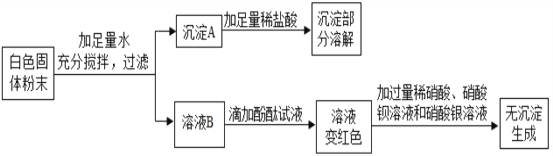
下列判断正确的是
A. 原固体中一定有Ba(NO3)2、NaOH、CuSO4 和Na2SO4
B. 沉淀 A 中一定有Cu(OH)2 和BaSO4
C. 溶液 B 中一定有NaOH 和 Na2SO4,一定没有CuSO4
D. 原固体中一定没有 NaCl和Na2SO4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合下列实验装置,回答有关问题。
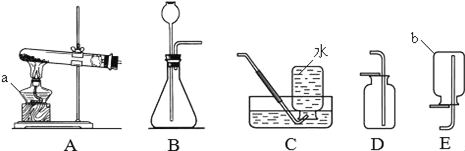
(1)写出仪器b的名称:_____________。
(2)实验室用加热高锰酸钾制取并收集氧气,应选择的装置为____________(填字母),发生反应的化学方程式为________________________。
(3)实验室用石灰石与稀盐酸反应制取并收集二氧化碳,应选择的装置为_______(填字母)。在一定条件下,二氧化碳气体会变成固体,固体二氧化碳叫做__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将硫酸钠和硫酸铜的混合固体溶于199.2克水中配成溶液,,完全溶解后加入溶质质量分数为10%的氢氧化钠溶液至恰好完全反应,生成19.6克沉淀,过滤后将滤液蒸干后所得固体质量为56.8克,试计算:
①加入氢氧化钠溶液的质量;
②原混合固体的质量;
③反应后所得滤液中溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定质量AgNO3和Cu (NO3 )2的混合溶液中加入过量的Zn粉,溶液质量随反应时间变化的情况如图所示。下列说法正确的是( )
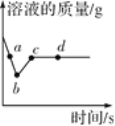
A. 取a点溶液,滴加稀盐酸,无白色沉淀
B. 图标上b~c段质量增加的原因是Zn与Cu(NO3)2溶液反应
C. b点时溶液中金属离子有Zn2+、Cu2+,金属单质有Zn、Cu、Ag
D. c点和d点溶质种类不同,金属单质种类也不同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
I.探究铜锈的组成
【查阅资料】① 铜锈受热易分解 ② 硫酸铜粉末遇水由白色变为蓝色
【进行实验】 小组同学从铜器上取下适量的干燥铜锈,按图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
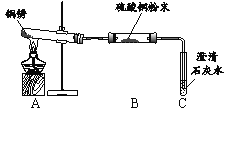
【解释与结论】(1)C中反应的化学方程式是______。
(2)依据以上现象分析,铜锈中一定含有的元素:Cu和______。
II.探究铜生锈的条件
【提出猜想】根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
【进行实验】实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 | 无明显现象 |
【解释与结论】
(3)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是______。
(4)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是______(填编号)。
(5)对比实验②和③,得出的结论是______。
(6)为验证猜想,请在图中将实验⑤补充完整。______
(7)由上述实验可推知,铜生锈的条件是______。
【反思与应用】
(8)结合上述实验,你对保存铜制品的建议是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com