
����Ŀ����������ʵ�鳣��װ�ã��ش��й�����
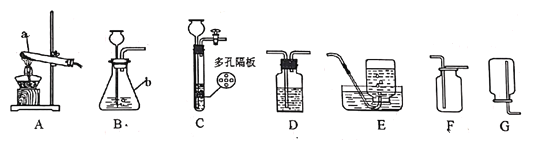
(1)д��ͼ�б�����ĸ���������ƣ�a__________��b_________
(2)���ø��������ȡ������Ӧѡ�õ��ռ�װ����________����Ӧ�Ļ�ѧ����ʽ��____________
(3)ʵ������װ��BDF�����ȡ����Ķ�����̼����ʱ��D��ʢ�ŵ��Լ���___________���Bװ�ø�ΪCװ�ã����ŵ���_________________________________ʵ������ȡ������̼�ķ�Ӧ����ʽΪ_________
(4)�����Ȼ�粒������ʯ�һ�ϼ�����ȡ����(�����ܶ�С�ڿ����Ҽ�������ˮ)����Ӧѡ�õ�װ�������____________��֤�������Ѿ��ռ������ڼ���ƿ�ڷ�һ��_____________��ֽ
���𰸡��Թ� ��ƿ E��F 2KMnO4![]() K2MnO4+MnO2+O2�� Ũ���� ���Կ��Ʒ�Ӧ�Ŀ�ʼ����� CaCO3+2HCl=CaCl2+H2O+CO2�� AG ʪ��ĺ�ɫʯ����ֽ
K2MnO4+MnO2+O2�� Ũ���� ���Կ��Ʒ�Ӧ�Ŀ�ʼ����� CaCO3+2HCl=CaCl2+H2O+CO2�� AG ʪ��ĺ�ɫʯ����ֽ
��������
��1��ͼ�б�����ĸa���������Թܣ�ͼ�б�����ĸb����������ƿ��
��2��������������ˮ���ܶȱȿ���������ˮ���������ſ������ռ������ø��������ȡ����,Ӧѡ�õ��ռ�װ����E��F��������ؼ��ȷֽ���������ء������Ͷ������̣���Ӧ�Ļ�ѧ����ʽΪ��2KMnO4![]() K2MnO4+MnO2+O2����
K2MnO4+MnO2+O2����
��3��Ũ���������ˮ�ԣ��ܸ��������̼���壬D��ʢ�ŵ��Լ���Ũ���ʵ������ȡCO2�����ڳ����£��ô���ʯ��ʯ��ʯ��ϡ������ȡ����װ��C�У�����ʯ��ʯ��ʯ����ڶ�����ϣ�ϡ����ӳ���©���м��롣�رտ���ʱ���Թ��е��������࣬ѹǿ����Һ��ѹ�볤��©���������Һ����룬��Ӧֹͣ������ʱ�����嵼�����Թ��е�������٣�ѹǿ��С��Һ������ϣ���Ӧ���С�Bװ�ø�ΪCװ�����ŵ��ǿ�����ʱ���Ʒ�Ӧ�ķ�����ֹͣ������ʯ��ʯ��ʯ����Ҫ�ɷ���̼��ƣ�̼��ƺ����ụ�ཻ���ɷ������Ȼ��ƺ�ˮ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��CaCO3+2HCl=CaCl2+H2O+CO2����
��4��ʵ�������Ȼ�粒������ʯ�ҹ����ϼ�����ȡ����ʱ����Ӧ���ǹ��壬��Ӧ�����Ǽ��ȣ�������������ˮ���ܶȱȿ���С�����ֻ���������ſ������ռ�����ȡ�ð���Ӧѡ�õ�װ�������AG����������ˮ�ʼ��ԣ���ʹʯ����Һ����ɫ��֤���������������ڼ���ƿƿ�ڷ�һ��ʪ��ĺ�ɫʯ����ֽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�о���ѧϰС��ͬѧȡ 10g ʯ��ʯ��Ʒ����������ϡ����ⶨʯ��ʯ��̼��Ƶ���������������ʯ��ʯ�����ʲ������ᷴӦ�������� 5 ���������� CO2 �������������±���
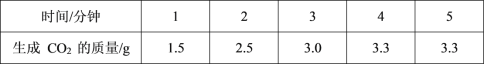
��ش��������⣺
I.ʯ��ʯ�е� CaCO3 ��ȫ��Ӧʱ�����ɶ�����̼��������ʵ���Ϊ_____mol��
II.��ʯ��ʯ�� CaCO3 �����������Ƕ���_______�������ݻ�ѧ����ʽ��ʽ���㣩
III.����ݱ������ݷ��������ܷ������ݱ���Ļ�ѧ��Ӧ������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬѧ���ڰ���ʦ����ʵ����ʱ������ʯ��ˮ�Լ�ƿƿ�ں�ƿ����Χ��һЩ��ɫ��ĩ��Ϊ��Ū�����ɫ��ĩ�ijɷּ��γ�ԭ�����ǽ���������̽����
�����ϣ������Ǽ������ʳ���ʱ���ܼ�����
����̪�Լ���������Һ���ɫ��ʯ��ˮ��Һ�Լ���
OH�� | Cl�� | CO32�� | NO3�� | |
Ca2+ | | �� | �� | �� |
��1����ɫ��ĩ�ɷֵIJ���ͳ���
��ɫ��ĩ�ijɷ� | �γɵ�ԭ�� |
������CaCO3 | ��Ӧ�Ļ�ѧ����ʽΪ��_____ |
������Ca��OH��2 | ������½ϸߣ����ʵ��ܽ�Ƚ��ͻ��ܼ�������ʯ��ˮ�е����ʽᾧ���� |
��������˼����ͬѧ����Ϊ��ɫ��ĩ�������Ƕ��ߵĻ���
��2�����ʵ�飺��ͬѧȡ��ɫ��ĩװ���Թ��У���������ˮ�������а�ɫ���岻�ܽ⣬�������ó���ĩ��һ����CaCO3��������Ϊ��ͬѧ�Ľ��۲����ܣ�������_____��Ϊ�˵ó������ܵĽ��ۣ����ǽ���������ʵ�飬���������ʵ�鱨�棺
ʵ�鲽�� | ���ܹ۲쵽������ | ���� |
ȡ�����Թ��е��ϴ���ҹ���μ�1��2����ɫ��̪��Һ | _____ | _____ |
�������Թ��еIJ��������м���ϡ���� | _____ | ��ɫ��ĩ_____�����С����ޡ���CaCO3 |
������ʵ���֪��ɫ��ĩ�ijɷ��ǣ�_____�� | ||
��3��ʵ��Ӧ�ã���ʢ��̼��Ʒ�ĩ���Թ��м���������ϡ���ᣬ��ȫ��Ӧ���ռ���4.4g������̼���壬�Լ��㷴Ӧ���ĵ�̼��Ƶ�����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����ͬѧ��þ�����ᷴӦ����ϵ���о���
�ס�����ͬѧȡһ��þ����������ɰֽ��ĥ��ȥ_______���۲쵽þ������ɫ_______��
�о���þ�����ᷴӦ�����е������仯�Լ���Ӧ���ʵı仯��
(1)��Ӧ���Թ���ڷ��̣�˵��þ��ϡ���ᷴӦ��_______��Ӧ(��������������������)����Ӧ�Ļ�ѧ����ʽ��________��
(2)ʵ����þƬ�������������(v)��ʱ��(t)�Ĺ�ϵ��ͼ��ʾ��
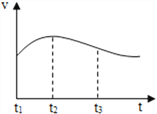
��t1-t2�ڷ�Ӧ�����ӿ����Ҫԭ����________��
��˼��t2-t3�ڷ�Ӧ������������Ҫԭ����_________��
�о���Ӧ��������Һ�������̽����
(3)��pH��ֽ�ⶨ��Ӧ��������Һ�����ȣ�����pH��С��7��
��ͬѧ�������ϡ���������������Ȼ�þ��Һ�������ԡ�
��pH��ֽ�ⶨ�����ȵķ�����_______��Ϊ��֤�������ȷ������ͨ���������ϣ�Ҳ����ȡ������________��Һ���ⶨ�����ȡ�
(4)��ͬѧ��þƬ(��ʣ��)Ͷ������ϡ���ᣬ�����ٲ�������ʱ��������pH��ȴ����������ҺpH����7����Һ��ȴ�����º�pHС��7���������Ϸ��֢�Mg+2H2O��Mg(OH)2��+H2������20��ʱSMg(OH)2=0.009g��80��ʱ SMg(OH)2=0.0108g���������ϣ���ͬѧʵ����pH�����仯��ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���б�����ͼ�dz��õ����ݴ����������������ͼ���ж�����˵����ȷ���ǣ� ��
�������ơ�̼���Ʒֱ���ˮ���ƾ��е��ܽ��
�������� | ̼���� | |||
20�� | 40�� | 20�� | 40�� | |
ˮ | 109g | 129g | 21.8g | 49g |
�ƾ� | 17.3g | 40g | ���� | ���� |
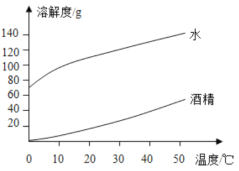
A��ͼ���������ܷ�ӳ�¶ȶԹ��������ܽ�ȵ�Ӱ�죬���б�����ŵ��DZ仯���ɸ�ֱ��
B���ɱ������ݿ�֪�����ʵ��ܽ��ֻ���¶�Ӱ��
C��40��ʱ����50g NaOH�ֱ�Ͷ�뵽100gˮ�;ƾ��ж��ܵõ�������Һ
D��40��ʱ����CO2ͨ�뱥�͵�NaOH�ƾ���Һ���г�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ֧�Թ��з���һС��þ��(�Ѳ�ȥ����Ĥ)�������Թ��м���һ���������ᣬþ��������_____��������Ӧ�Ļ�ѧ����ʽ��_____��
[��������]Ϊ���ٴι۲�������Ӧ����С��ͬѧ�ýϳ���þ����������ʵ�飬���������쳣�����Թ��г����˰�ɫ������
[ʵ����֤1]С��ͬѧ�������ʵ��IJ�ͬ����ƶԱ�ʵ�鷽����̽�������쳣�����ԭ��
[�ó�����]þ�������ᷴӦ������ɫ������_____�йء�
[��]��ɫ������ʲô���ʣ�
[��������]��20 ��ʱ��100 gˮ��������ܽ��Ȼ�þ54.8 g��
��þ������ˮ��Ӧ����һ�ּ��������
���Ȼ����Ȳ�����ˮҲ������ϡ���ᡣ
[��������]����һ��þ����������Ȼ�þ����������������þ�������������_____(�û�ѧ����ʽ��ʾ)��
[ʵ����֤2]����ɫ����ϴ�Ӹɾ����ֱ�ȡ����������A��B��C�Թ��У��������ʵ�飺
�Թ� | ���� | ���� | ���� |
A | ������������ | _____����ɫ����_____ | ����һ����ȷ�������ְ�ɫ�������������� |
B | ��������ˮ | ��ɫ����_____ | ���������ȷ |
C | ��������ϡ���� | ��ɫ������ʧ | ԭ��ɫ�����к��е������ǣ�Mg2+��_____ |
�����μӼ�����������Һ | ���ִ�����ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����9�֣�ij��ѧС��������ͼ��ʾװ�ã�ͼ�й̶�װ������ȥ���ⶨͭп�Ͻ���п������������
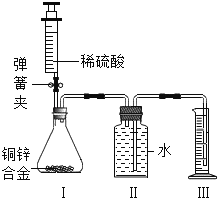
̽���������£�
������ʵ��װ�ò����װ�������ԣ�
����װ�����е���ƿ����2��0g��ͭп�Ͻ���Ʒ��ĩ����ע��������ע��ϡ���ᣬ������ƿ�в��ٲ�������ʱ��ȷ��ȡע�����ڶ���������10��5mLϡ���ᣬͬʱ�����н����ɼУ��Ƴ�װ�����еĵ��ܣ�ȷ��ȡ��Ͳ��ˮ�����Ϊ214��0mL����ע����Ʒ�е����ʲ��μӷ�Ӧ��
��װ������ʣ��������ʾ����ʵ�������ȷ����������1��4g��
����С�����λͬѧ����ʵ����̲�ò�ͬ���ݣ�����ͭп�Ͻ���Ʒ��п������������
��ͬѧ����װ�����з�Ӧǰ�������������м��㣻
��ͬѧ����װ�����м���ϡ����������м��㣻
��ͬѧ����װ��������ȡˮ��������м��㣬����ã��ڱ�״���£��������ܶ�Ϊ0��09g/L��
�ش��������⣺
��1��װ�����з�Ӧ�Ļ�ѧ����ʽΪ ��ʵ������������ϡ���������ٲ������壬Ŀ���� ��
��2���������г���ʣ�����֮ǰ����ȷ������ ��ϴ�ӡ����
��3������ʵ��ⶨ�����ݣ�������λͬѧ�� ����������������������������ͬѧ�����м�����Ʒ��п������������
��4����ѧС��ͬѧ���֣����ձ�ͬѧ�ķ������м��㣬��ʹʵ�������ֽϴ�ƫ��������ؿ������ƫ����� �����ţ���
A���Ƴ�װ����ʱ��������������һ����ˮ
B��ʵ�����ǰ��û���ų�װ�����еĿ���
C�����ݴ���ʱ��δ�ų�����ϡ������ռ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������һƿʧȥ��ǩ��NaOH��Һ��Ϊ�ⶨ��Һ��NaOH������������ȡm2 g NaOH��Һ���������У�����m1 g��������Ϊ10.0%�����ᣬ�������ɴ�ʵ�飨ʵ����ʼ�ձ���m1+m2=50g������������¼ÿ��ʵ����Һ���Ȼ�Ϻ������¶ȣ�ʵ������ͼ��ʾ��
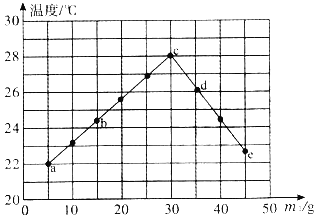
��1��ͼ��____���ʾ������NaOH��Һǡ����ȫ��Ӧ�����ţ���
��2��������Һ��NaOH�����������������ȷ��0.1%����____
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com