【答案】
分析:【建立假设】根据氢氧化钠易吸收空气中的二氧化碳反应生成碳酸钠而变质猜想;
【设计实验】根据碳酸盐能与稀盐酸反应生成二氧化碳气体来验证;
【反思与思考】(1)根据氢氧化钠可能是部分变质分析;
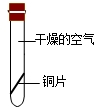
(2)根据潮解的定义分析:暴露在空气中的固体物质吸收空气中的水蒸气而逐渐溶解的现象;
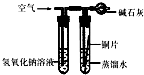
(3)利用反应物中的氢氧化钠溶液能与二氧化碳反应的有关原理解决该问题,假设使用该装置则反应时氢氧化钠会与二氧化碳反应使左边的物质质量增加,天平不会平衡;
(4)为得到纯净的氢氧化钠,可利用碳酸钠能与氢氧化钙生成氢氧化钠的变化关系,向溶液中加入适量的氢氧化钙溶液;
(5)在本题中首先根据溶质的质量分数公式求硫酸钠的质量,然后根据化学方程式中,已知硫酸钠的质量求氢氧化钠和硫酸的质量,再根据硫酸的溶质计算硫酸的质量分数.
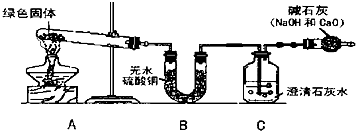
解答:解:【建立假设】氢氧化钠易吸收空气中的二氧化碳反应生成碳酸钠而变质,故该固体可能是碳酸钠;
【设计实验】碳酸钠能与稀盐酸反应生成二氧化碳气体来检验含有碳酸根离子;故为:
| 实验方法及操作 | 可能观察到的现象 | 实验结论 |
| 取白色粉末少许置于试管中加稀盐酸 | 有气泡产生 | 有碳酸钠存在 |
【反思与思考】(1)若氢氧化钠是完全变质,则表示固体只有碳酸钠,若是部分变质则含有碳酸钠和氢氧化钠;
(2)暴露在空气中的固体物质吸收空气中的水蒸气而逐渐溶解的现象叫潮解,因此这个现象说明了空气中含有水蒸气;
(3)在硫酸铜与氢氧化钠反应的同时,由于氢氧化钠能与二氧化碳反应,会使溶液的质量增加,导致天平不会平衡,因此设计不严密;
(4)为除去溶液中的碳酸钠而得到纯净的氢氧化钠溶液,向溶液中加入适量的氢氧化钙溶液,使变质形成的碳酸钠再转化为氢氧化钠,为不引入新的杂质所加氢氧化钙溶液要恰好完全反应;此时反应的化学方程式为Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH;
(5)解:142g硫酸钠溶液中含有硫酸钠的质量:142g×10%=14.2g
设样品中含氢氧化钠的质量为x;稀硫酸中硫酸的质量为y.
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98 142
x y 14.2g
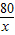
=
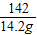
x=8g
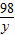
=
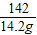
y=9.8g
稀硫酸的溶质质量分数为:
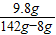
×100%=7.3%
答:样品中氢氧化钠的质量是8g;加入的稀硫酸的溶质质量分数是7.3%.
故答案为:【建立假设】白色粉末可能是碳酸钠;
【设计实验】
| 实验方法及操作 | 可能观察到的现象 | 实验结论 |
| 取白色粉末少许置于试管中加稀盐酸 | 有气泡产生,生成的气体能使澄清石灰水变浑浊 | 有碳酸钠存在 |
【反思与思考】(1)氢氧化钠和碳酸钠的混合物;(2)水蒸气;(3)该设计不严密,因为氢氧化钠能与空气中的二氧化碳反应会使溶液的质量增加,使结果不准确;(4)Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH;
(5)解:142g硫酸钠溶液中含有硫酸钠的质量:142g×10%=14.2g
设样品中含氢氧化钠的质量为x;稀硫酸中硫酸的质量为y.
2NaOH+H
2SO
4=Na
2SO
4+2H
2O
80 98 142
x y 14.2g
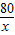
=
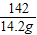
x=8g
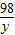
=
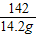
y=9.8g
稀硫酸的溶质质量分数为:
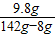
×100%=7.3%
答:样品中氢氧化钠的质量是8g;加入的稀硫酸的溶质质量分数是7.3%.
点评:此题重点考查了氢氧化钠与二氧化碳反应的性质,以及碳酸盐的检验方法,并根据质量守恒定律的探究来说明氢氧化钠易变质的性质,另外还考查了根据化学方程式的计算来研究氢氧化钠与酸反应的性质,综合性较强,要求要对常见的酸、碱、盐等的性质熟练掌握.

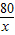 =
=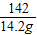 x=8g
x=8g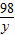 =
=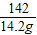 y=9.8g
y=9.8g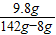 ×100%=7.3%
×100%=7.3%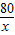 =
=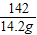 x=8g
x=8g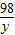 =
=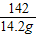 y=9.8g
y=9.8g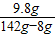 ×100%=7.3%
×100%=7.3%

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案