
����Ŀ���Ķ�������Ϣ���ϣ����ش�������⣺
��������ѧʽΪ![]() �����³�ѹ��Ϊ����ɫ����ǿ�Ҵ̼�����ζ���ж����壬�ܶȱȿ���������ˮ����ѹ������Һ��Ϊ���ɫҺ̬�ա������л���������Ϊ5%���ϵ�����ʱ����ǿ��ᷢ�����ҵĻ�ѧ��Ӧ�����Ȼ������壬�ų�������ʹ���弱�����ͣ�������ɱ�ը��Σ�գ�����������������Ծ���ȼ�գ����������İ��̣�ͬʱ�ų����������������ڳ���Ϊ��ֽ����֯��ҵ��Ư������������ͨ��ˮ�У�������
�����³�ѹ��Ϊ����ɫ����ǿ�Ҵ̼�����ζ���ж����壬�ܶȱȿ���������ˮ����ѹ������Һ��Ϊ���ɫҺ̬�ա������л���������Ϊ5%���ϵ�����ʱ����ǿ��ᷢ�����ҵĻ�ѧ��Ӧ�����Ȼ������壬�ų�������ʹ���弱�����ͣ�������ɱ�ը��Σ�գ�����������������Ծ���ȼ�գ����������İ��̣�ͬʱ�ų����������������ڳ���Ϊ��ֽ����֯��ҵ��Ư������������ͨ��ˮ�У�������![]() ��
��![]() �������ᣩ���������������ɱ�������ã���������Ҳ����������ˮ������
�������ᣩ���������������ɱ�������ã���������Ҳ����������ˮ������
��1����������Ҫ����������_________________��
��2���������������ȼ�գ������ġ����̡���________________��
��3��![]() �������ᣩ����Ԫ�صĻ��ϼ���________________��
�������ᣩ����Ԫ�صĻ��ϼ���________________��
��4��������������Ӧ�����ֱ���ʽΪ��_________________��
���𰸡����³�ѹ��Ϊ����ɫ����ǿ�Ҵ̼�����ζ�����壬�ܶȱȿ���������ˮ����ѹ������Һ��Ϊ���ɫҺ̬�� �Ȼ��ƹ���С���� ![]()
![]()
��������
��1����������Ҫ���������У����³�ѹ��Ϊ����ɫ����ǿ�Ҵ̼�����ζ�����壬�ܶȱȿ���������ˮ����ѹ������Һ��Ϊ���ɫҺ̬�ȣ�
��2���������������ȼ�յķ�Ӧԭ����2Na��Cl2![]() 2NaCl�����������������ǣ��Ȼ��ƹ���С����;
2NaCl�����������������ǣ��Ȼ��ƹ���С����;
��3��![]() �������ᣩ�У���Ԫ����+1�ۣ���Ԫ����-2�ۣ�����Ԫ�ػ��ϼ�Ϊx�����У���+1��+x+��-2��=0����x=+1����Ԫ�صĻ��ϼ��ǣ�+1�ۣ�
�������ᣩ�У���Ԫ����+1�ۣ���Ԫ����-2�ۣ�����Ԫ�ػ��ϼ�Ϊx�����У���+1��+x+��-2��=0����x=+1����Ԫ�صĻ��ϼ��ǣ�+1�ۣ�
��4��������������Ӧ�����Ȼ��⣬��Ӧ�����ֱ���ʽΪ������+����![]() �Ȼ��⡣
�Ȼ��⡣


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȵ������ձ���װ���������п�ۺ����ۣ��ٷֱ����������ȡ���������������ͬ��ϡ�����У�������������(m)�淴Ӧʱ��(t)�ı仯������19��ͼ��ʾ������˵���������( )
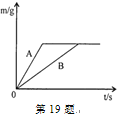
��A��ʾп��ϡ����ķ�Ӧ����
�ڷ�Ӧ���������ֽ���һ������ʣ��
��������Һ�е�����һ������Ӧ��
�ܷ�Ӧ����п������������Ϊ56:65
�ݷ�Ӧ�������������ֽ������������
��Ӧ���������ձ������ʵ��������
A.2��B.3��C.4��D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߡ��±�ΪԪ�����ڱ��в���Ԫ�ص������Ϣ���������±��ش�������⣺
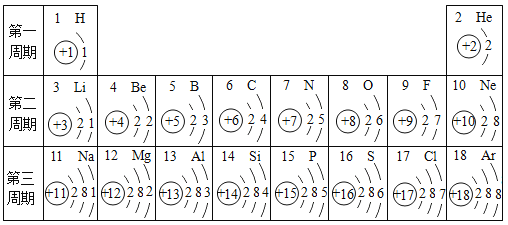
��1����Ԫ�ص�ԭ��������___________��������_________�����������������ǽ�������Ԫ�أ�������Ԫ��λ��Ԫ�����ڱ��еĵ�_______���ڡ�
��2����Ԫ�صĻ�ѧ���ʹ�ϵ�����е���ԭ�ӵ�________������Ԫ����������ԭ�ӵ�________����Ԫ�غ���Ԫ�ز�ͬԭ����______________��
��3���������ں�������Ų��Ĺ�����___________��
��4��д����������Ų�����ԭ����ͬ�������ӷ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MnSO4H2O�ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�á�
��һ���Ʊ�����ҵ���û�����β���е�Ũ��SO2�����̿���Ҫ�ɷ�MnO2�����ʽ���Ԫ��Mg��Al��Fe�ȣ��Ʊ�MnSO4H2O�������£�
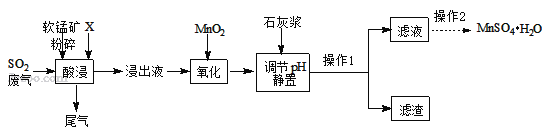
��֪������Һ����������Ҫ��H+��Mn2+��Mg2+��Fe2+��Al3+�ȣ����������з�������Ҫ��Ӧ��ѧ����ʽΪ��MnO2+SO2=MnSO4��
��1�������н����̿�����Ŀ����____��
��2������X���ѡ��_____��
a.���� b.���� c.����
��3�����ʱSO2������Ч����pH���¶ȵĹ�ϵ����ͼ��ʾ��Ϊ���SO2������Ч�ʣ����ʱpH������____���ң��¶ȿ�����_________�����������ˡ�
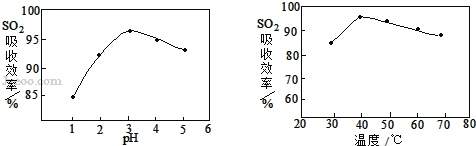
��4���������������������Ŀ���ǽ�Fe2+ ����ΪFe3+�������Ʒ�Ӧ�Ļ�ѧ����ʽMnO2+2FeSO4+_______ = MnSO4 + Fe2(SO4)3 + 2H2O����
��5������ʯ�ҽ�����pH���ɽ�������Ľ���Һ�����������γ����������ȥ��
��֪����һ���й������������pH��Ӧ��
�������� | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
��ʼ����pH | 1.8 | 4.1 | 8.3 | 9.4 |
��ȫ����pH | 3.2 | 5.0 | 9.8 | 12.4 |
������Fe3+����KSCN��Һ������Ѫ��ɫ���ʯ�ҽ�ʱӦ������Һ��pH��ΧΪ_________���ⶨ��Һ��pH���ѡ____��a.pH��ֽ b.pH�ƣ�������Fe3+�Ƿ��������ѷ�����________��
��6������1�������˺�ϴ�ӣ������õ��IJ����������ձ�����������_____��ϴ�ӵ�Ŀ����________
��7����֪�����̡�����þ�ᾧˮ������ܽ��������ͼ�������2����������Ũ����___________�����ˡ�ϴ�ӡ����
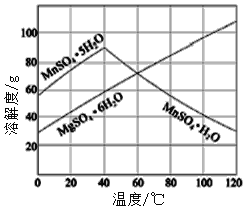
������Ӧ�ã�
��8����MnSO4�ɲⶨˮ���ܽ����������ǣ�ȡ100mL ˮ����Ѹ�ټ�������MnSO4��Һ������NaOH��KI��Һ�������������ӡ���ʹ֮��ַ�Ӧ�������ӣ�Ѹ�ټ���������ϡ���ᣬ��ʱ��I2���ɣ�����0.79gL��1Na2S2O3��Һ��I2��Ӧ��������Na2S2O3��Һ 12.0mLʱ��Ӧ��ȫ���йػ�ѧ��Ӧ����ʽ�£�
��2MnSO4+O2+4NaOH=2MnO(OH)2+2Na2SO4��
��MnO(OH)2 + 2KI + 2H2SO4 = MnSO4 + K2SO4 + I2 + 3H2O��
��I2 + 2Na2S2O3 = Na2S4O6 + 2NaI��
����ˮ�����ܽ�����Ũ�ȣ���mgL-1Ϊ��λ����д���������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��ѡ��ȼ��þ�����ж���ʵ���о�
�����ϣ�þ����������е�������Ӧ�⣬������������еĵ����ڵ�ȼ���������ɹ��嵪��þMg3N2����һ��ͬѧ������0.2gþ�����ڿ����е�ȼ����ȫȼ�պ������ù�������Ϊ0.30g���ڶ�С��ͬѧ���õ�һС���ʵ�����ݲ�����������ԭ�����������ͼ��ʾ��ʵ�飬ʵ�鲽�����£�
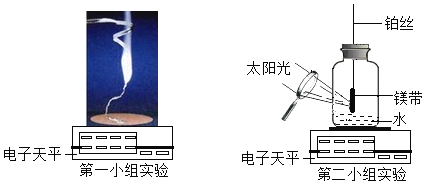
����һ����0.24g��ĥ������þ���̶��ڴ���ƿ���IJ�˿��(��˿����Ӧ)�����ƿʢ������������ƿ��(��ͼ��ʾ)��ƿ������������ˮ��
��������о۹⾵��ȼþ����������ȫȼ�պ����ƿ�ڵ�ˮ�پ��ã�ƿ�ڰ�����ȫ��ʧ���а�ɫ���������ƿ�ף�(������������þ������ˮ�Ҳ���ˮ��Ӧ)
����������ƿ��ȫ���Ĺ�Һ�������ˣ�������ֽ��������������һ�������������Ϊ0.75g.(������ʧ���Բ���)
��ش��������⣺
(1)д��þ���ڿ�����ȼ�յĻ�ѧ����ʽ(ֻдһ��)_______
(2)��������С��ʵ���˵����ȷ����_____
A ��һ��ʵ�����ݲ���������Ϊ0.3g>0.24g����������������
B �ڶ���ʵ���е�ˮ�ȿ��Լ���װ����ȴ���ֿ���ͨ��ˮ�����ռ�ƿ�ڵ�������
C þ��ȼ��ʱ�а���Ʈɢ������˵������������ͣЪ���������˶���
D ͨ����һ��ʵ�����ݿ����Ʋ⣬þ�ڿ�����ȼ��һ�������˵���þ
E �ڶ�С��ͬѧֻ�����þ��ȼ��ǰ���յĹ��ƿ��ϵ����������������֤�����غ㶨�ɶ���
(3)�ڶ�С��ͬѧ�ڽ���ʵ��ʱ����δ��ĥȥ��þ�����������Ĥ��������dz�������ֽ��������������____0.75g(��> < =)
(4)���ݵڶ�С��ͬѧ��ʵ�����ݣ���Ҫ�õ���������Ӧ�����������������___��ʵ�����������غ����Ǻϣ����Ʋ����ϲ���ֵΪ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ������գ�2��������̼����________��3�����������________���Ȼ�þ��þԪ�ػ��ϼ�Ϊ+2��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��ͼ�ش����
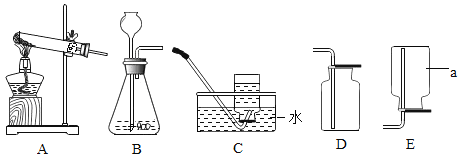
��1��д������a�����ƣ�______________��
��2��ʵ�����ü��ȸ�����صķ�����ȡ���ռ�������Ӧѡ�õķ���װ��Ϊ___________������ţ���ͬ������Ҫ�ռ��ϴ��������������ռ�װ��Ϊ______________��
��3��ʵ�����ù���������Һ�Ͷ���������ȡ���ռ�����������D�ռ�������������Ƿ��ռ����IJ���Ϊ______________����ȡ������Ӧ�����ֱ���ʽΪ______________��
��4���Ƚ�����������ȡ�����ķ�������ָ���ù���������Һ�Ͷ���������ȡ�������ŵ��У�дһ�����ɣ�_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ƭ�ı�ǩ����,��֪�˸�Ƭ�ɷ���ֻ��̼���CaCO3���и�Ԫ�ء�

��1���߸�Ƭ�еġ��ơ�Ӧ����Ϊ ___________������ţ�
��Ԫ�� ��ԭ�� �۷��� �ܵ���
��2��ά��������϶�,����ά����D2�Ļ�ѧʽΪC28H44O,��ά����D2����Է�������Ϊ_________��ά����D2��C��H��O����Ԫ�ص�ԭ�Ӹ���֮��Ϊ______
��3�����һ��������ÿ����Ҫ����0.8�ˣ�����0.6�˶�������ţ�̣�������ø�Ƭ�������ÿ������Ҫ����̼��ƶ��ٿˣ���Ҫ���м�����̣�________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ѧ�û�ѧ�Ļ�������д������Ҫ��Ļ�ѧ���Ż��塣
�ٺ���_______��3��������_______��![]() _______��
_______��![]() ________��
________��
�ڵ��������������___________����������ЧӦ������__________��
�ۻ���̿ȥ�������е���ζ��������������____________�ԡ�
�ܵ���е��ܼ���__________�������ƣ���
����ʯ�ҿ�����������ѩ�������������ԭ���û�ѧ����ʽ��ʾ_____________��
���������ܻ�Ѫ���ס���ʹֹ��������Ҫ�ɷ�Ϊ�����ԣ�C10H1OO��������______��Ԫ����ɣ���Ħ��������______��̼����Ԫ�ص�������________����Ԫ����ռ������������________����ȷ��0.01%����73g�����Ե����ʵ�����_______mol��1mol�����Է���Լ��_________����ԭ�ӡ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com