
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且不与空气中的成分反应 |
| 收集过程分析 | 集满现象瓶口有大气泡冒出 | “验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭, 也难以证明空气完全排尽 |
| 向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短 | 先浑浊后变澄清所需时间较长 |
| 由上述实验可得结论 | ①用排水法收集满二氧化碳现象明显; ②排水法收集到的二氧化碳纯度更高. | |
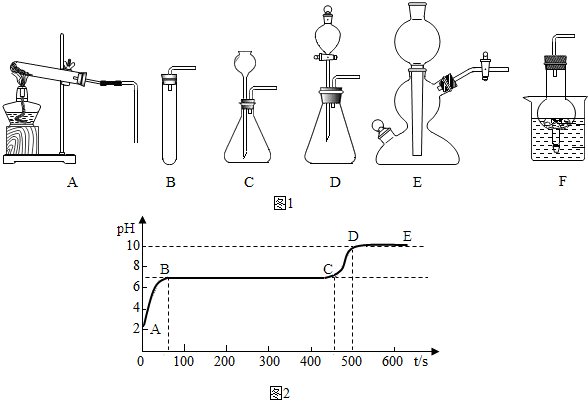
分析 实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,根据反应物的状态和反应条件选择发生装置;根据装置E或F和C装置制取气体的过程考虑优点;从选择气体收集方法的依据和收集气体时的操作注意事项进行分析.根据图象结合物质间的反应进行分析解答.
解答 解:(1)实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;发生装置属于固液常温型,所以可以选择BCDEF,故填:石灰石和稀盐酸;BCDEF;
(2)装置E或F可以通过控制活塞的开关从而控制反应的发生和停止,相对于装置C在操作方面的优势为:可以使反应随时发生随时停止;故填:随开随用,随关随停;
(3)能用向上排空气法收集的气体必须满足密度比空气大,不与空气发生反应等条件;用排水法收集气体时,当看到集气瓶口有气泡冒出,说明集气瓶中的水已排完,气体已收集满;通过实验分析可知,二氧化碳可用排水法或向上排空气法收集,用排水法收集二氧化碳时能看到什么时候收集满,而用向上排空气法则不能,因而用排水法收集到的二氧化碳比较纯净.故填:
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且 不与空气中的成分反应 |
| 收集过程分析 | 集满现象 瓶口有大气泡冒出 | “验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭, 也难以证明空气完全排尽 |
| 向收集到CO2的集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短 | 先浑浊后变澄清所需时间较长 |
| 由上述实验可得结论 | ①用排水法收集满二氧化碳现象明显; ②排水法收集到的二氧化碳纯度更高. | |
点评 本题中的固-液不加热型发生装置比较多,要把每个装置的用法和优点弄清楚;气体的收集方法主要取决于气体的密度和溶水性,另外还要考虑气体是否有毒、是否与水反应、是否与空气反应等.


科目:初中化学 来源: 题型:选择题
| A.日常生活经验 | B.实验中的注意事项 |
| 去除衣服上的油污:用汽油洗涤 区别硬水软水:常用肥皂水检验 使煤燃烧更旺:把煤做成蜂窝状 | 制取气体:先检查气密性 点燃气体:点燃前闻气味,可保安全 检验气体:都用石灰水检验即可 |
| C.粒子间的关系 | D.生活中的安全常识 |
| 分子与原子:分子由原子构成 原子与离子:原子得失电子变成离子 原子与元素:相同质子数的原子统称为元素 | 假酒中毒:由甲醇引起 瓦斯爆炸:由甲烷引起 煤气中毒:由一氧化碳引起 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 如图1是a、b、c三种物质的溶解度曲线,回答下列问题:
如图1是a、b、c三种物质的溶解度曲线,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
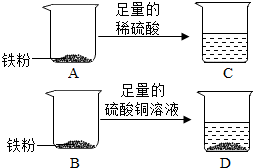 实验室有一包纯净的铁粉,小明为了探究金属的化学性质并测定铁的相对原子质量,设计了如图所示的实验.
实验室有一包纯净的铁粉,小明为了探究金属的化学性质并测定铁的相对原子质量,设计了如图所示的实验.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
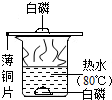 为了探究物质燃烧的条件,某同学设计了如图实验,下列关于烧杯中热水的作用说法错误的是( )
为了探究物质燃烧的条件,某同学设计了如图实验,下列关于烧杯中热水的作用说法错误的是( )| A. | 提高薄铜片的温度 | B. | 隔绝空气 | ||
| C. | 作反应物 | D. | 提高烧杯中白磷的温度 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 开发氢能源 | B. | 禁止使用煤、石油等矿物燃料 | ||
| C. | 使用电动车 | D. | 增加城市的绿地面积 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg和Mg2都属于镁元素 | B. | 质量相差很大 | ||
| C. | Mg和Mg2核外电子排布相同 | D. | Mg得到2个电子后能变为Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com