
【题目】酸、碱、盐是几类重要的化合物,他们之间能发生复分解反应。
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有_____生成。
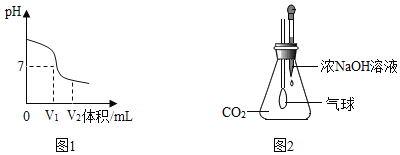
(2)图1是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。
①根据图示判断,该实验是将_____(填“氢氧化钠溶液”或“硫酸”)滴加到另一种溶液中。
②写出该反应的化学方程式_____。
③滴入溶液体积为V2mL时,溶液中的溶质为_____。
(3)图2是某趣味实验装置图。挤压胶头滴管后,可观察到气球胀大的现象。
①请分析其原因,并写出化学方程式_____。
②如何验证反应后溶液中含有的两种溶质。(请简要写出实验步骤及现象)_____。
【答案】水 硫酸 2NaOH+H2SO4=Na2SO4+2H2O Na2SO4、H2SO4 二氧化碳被浓NaOH溶液吸收,锥形瓶内的气压减小,外界大气压大于锥形瓶内的气压,使气球胀大。化学方程式为:2NaOH+CO2═Na2CO3+H2O 取反应后的少量溶液于试管中,先加入足量的CaCl2溶液,有白色沉淀产生,说明原溶液中含有碳酸钠,静置,取上层清液滴加无色酚酞,溶液变红色,说明原溶液中含有氢氧化钠
【解析】
(1)复分解反应发生的条件是有沉淀析出,或有气体放出,或有水生成;
(2)①由于滴加药品的过程中,pH在变小,所以该实验是将硫酸滴加到另一种溶液中;
②硫酸与氢氧化钠发生中和反应生成硫酸钠和水;反应的化学方程式:2NaOH+H2SO4=Na2SO4+2H2O;
③滴入溶液体积为V2mL时,此时pH小于7,说明硫酸过量,溶液中的溶质为生成的硫酸钠和过量的硫酸;
(3)①氢氧化钠溶液能与二氧化碳反应生成碳酸钠和水,而使瓶内的气体被消耗,压强变小,气球变大,所以原因是:二氧化碳被浓NaOH溶液吸收,锥形瓶内的气压减小,外界大气压大于锥形瓶内的气压,使气球胀大,化学方程式为:2NaOH+CO2═Na2CO3+H2O;
②碳酸钠溶液与氢氧化钠溶液均显碱性,氢氧化钠与氯化钙不反应,而碳酸钠能与氯化钙反应生成碳酸钙白色沉淀和氯化钠,所以检验反应后溶液中含有的两种溶质的方法是取反应后的少量溶液于试管中,先加入足量的CaCl2溶液,有白色沉淀产生,说明原溶液中含有碳酸钠,静置,取上层清液滴加无色酚酞,溶液变红色,说明原溶液中含有氢氧化钠。


科目:初中化学 来源: 题型:
【题目】图是常见物质的转化关系,其中X的浓溶液能挥发出剌激性气味的气体,A﹣D 的反应过程中有蓝色沉淀生成,E为白色沉淀。部分反应物、生成物及反应条件已省略。

(1)B的化学式为_____。
(2)写出X﹣D的化学方程式_____
(3)E的化学式为_____。X与AgNO3反应后所得溶液的pH_____7(选填“大于”小于或“等于”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列四个图象能正确反映其对应实验操作的是( )
A. 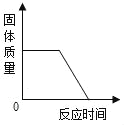 用一氧化碳气体还原一定质量的氧化铁粉末
用一氧化碳气体还原一定质量的氧化铁粉末
B. 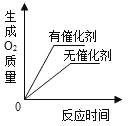 用两份等质量、等浓度的过氧化氢溶液分别制取氧气
用两份等质量、等浓度的过氧化氢溶液分别制取氧气
C. 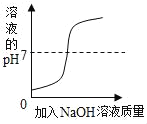 向一定体积的稀盐酸中逐滴加入足量的氢氧化钠溶液
向一定体积的稀盐酸中逐滴加入足量的氢氧化钠溶液
D. 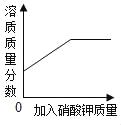 某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图回答下面试验中的问题:
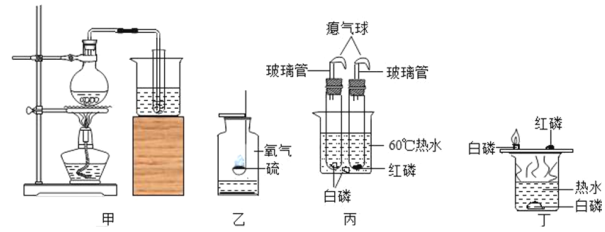
(1)装置甲可将硬水软化,该实验操作叫做_____.
(2)实验乙中可观察到的主要现象是_____,如果瓶内的液体是氢氧化钠溶液,其发生反应的化学方程式是_____.
(3)实验丙可以证明燃烧的条件:证明燃烧需要温度达到着火点的现象是_____.和丁相比该实验设计中有一个很明确的优点,它是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铝、铜、铁是人类应用广泛的三种金属.
(1)汽车生产需要大量钢铁.我市某炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如图所示:请写出其中一个反应的化学方程式_____。
![]()
(2)铝和铜常用于制导线,这是利用铝、铜等金属_____性.
(3)金属容易生锈,一种防锈的常用方法是在金属表面喷漆(或涂上油漆).在金属表面喷漆(或涂上油漆)能有效防锈的原因是_____。
(4)在空气中铝制品比铁制品更耐腐蚀,是因为铝具有“自我保护”作用.金属铝在空气中能“自我保护”的原因_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲烷和水反应可以制水煤气(混合气体),其反应的微观示意图如图所示:根据以上微观示意图得出的结论中。正确的是
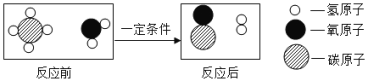
A.该反应属于置换反应
B.水煤气的成分是一氧化碳和氧气
C.该反应中含氢元素的化合物有3种
D.该反应的化学方程式中甲烷和水的计量数之比为1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组做了以下实验探究。向包有Na2O2的脱脂棉中吹气,发现脱脂棉剧烈燃烧起来。于是他们决定探究脱脂棉燃烧的原因。请你参与他们的探究。
【提出问题】脱脂棉为什么会燃烧?
【查阅资料】
(1)Na2O2是一种淡黄色固体,常温下能与CO2、H2O、HCl气体等物质发生反应,不能与N2发生反应。
(2)人呼出的气体的主要成分及含量:N2:74%;O2:16%;水蒸气:6%;CO2:4%
(3)CO2既不与NaHCO3反应,也不溶于饱和的NaHCO3溶液。
【猜想与假设】
(1)可能是CO2与Na2O2反应产生了O2,释放出热量。
(2)可能是H2O与Na2O2反应产生了O2,释放出热量。
(3)可能是____________与Na2O2反应产生了O2,释放出热量。
【实验验证】
实验I:验证CO2与Na2O2反应产生了O2,释放出热量。
同学们用下图所示的装置(部分夹持装置略去)进行实验验证猜想1成立。打开止水夹K,鼓入纯净、干燥的氮气一段时间后,关闭止水夹K.注入稀盐酸,观察到脱脂棉剧烈燃烧。
【解释与结论】
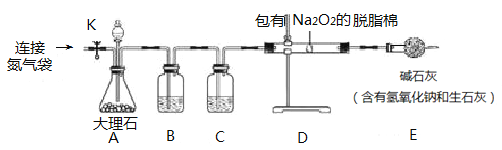
(1)从脱脂棉可燃烧的现象可知它是一种______________________。
(2)注入稀盐酸前鼓入纯净、干燥的氮气的目的是_______________。
(3)装置C中盛放的药品是_______________________。
(4)已知该反应还生成一种盐,则反应的化学方程式为_____________________。
实验II:验证H2O与Na2O2反应产生了O2,释放出热量。
(1)验证H2O与Na2O2反应产生了O2(略)
(2)验证H2O与Na2O2反应能释放出热量,请简述一个实验方案(写出实验步骤、现象及结论)_____。
【拓展与应用】保存过氧化钠时应注意______等事项.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )
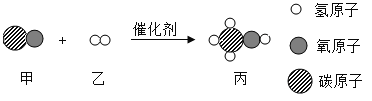
A. 甲和丙属于氧化物
B. 该化学反应属于化合反应
C. 参加反应的甲与乙的分子个数比为1:1
D. 反应前后原子和分子的数目都发生了改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀
盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.

(1)反应中生成二氧化碳质量;______
(2)通过计算说明每片钙片实际钙含量。说明是否与标注相符?______
(3)试计算所用稀盐酸的溶质质量分数.______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com