
| 方案 | 具体操作 | 实验现象 | 结论 |
方案一 | “除垢净”中一定有酸 | ||
| 方案二 |
分析 (1)根据酸能够和活泼金属反应生成氢气,能和碳酸盐类物质反应二氧化碳,进行分析解答.
(2)根据硫酸与碳酸钙反应生成的硫酸钙微溶于水进行分析解答.
(3)酸与活泼金属能反应,防止过量的盐酸与水垢反应后,再与铝反应;酸溶液有腐蚀性,据此进行分析解答.
解答 解:(1)根据酸的性质:能与活泼的金属反应生成氢气、能与碳酸钠等反应生成二氧化碳、能与金属氧化物等反应,且上述物质属于不同类物质,符合要求.因此可取少量待测液,加入铁钉,有大量气泡产生;或加入纯碱产生大量气泡,或将生锈铁钉放入到“除垢净”中,铁锈消失且溶液颜色逐步变为黄色;可说明“除垢净”的有效成分中一定有酸.
(2)盐酸与碳酸钙反应生成的氯化钙易溶于水,而硫酸与碳酸钙反应生成的硫酸钙微溶于水,影响除垢的效果,且盐酸是胃液的成分之一,配制“除垢净”更安全,故选用盐酸合适.
(3)“除垢净”的成分是盐酸,盐酸能与活泼金属反应,当除去铝壶中的水垢时要注意控制酸溶液的量,防止过量的盐酸与水垢反应后,再与铝反应,造成水壶腐蚀;酸液有腐蚀性,还要注意不要滴到手上或衣服上、防止腐蚀、除垢后要将“除垢净”冲洗干净等.
故答案为:(1)
| 方案 | 具体操作 | 实验现象 | 结论 |
| 方案一 | 取样于试管中,加入适量的蒸馏水,放入一枚洁净的铁钉, | 有气泡冒出,溶液变为浅绿色 | |
| 方案二 | 取样于试管中,加入适量的蒸馏水,放入一枚生锈的铁钉, | 红棕色固体溶解,溶液变为黄色. | |
| 方案三 | 取样于试管中,加入适量的蒸馏水,倒入纯碱溶液, | 有气泡冒出. |
点评 本题有一定难度,综合性较强,联系生产生活实际考查了利用酸的化学性质等解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 镁的相对原子质量为24.31g | |
| B. | 在化学反应中,氯原子容易失去1个电子 | |
| C. | 镁离子(Mg2+)核内有12个质子 | |
| D. | 镁离子(Mg2+)与氯离子(Cl-)的最外层电子数不相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①属于化合反应 | B. | ②属于置换反应 | C. | ③属于复分解反应 | D. | ④属于置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 小明见妈妈买了些取暖袋,他很好奇,打开了一袋,发现里面是黑色的粉末.那么,取暖袋里是什么物质在发生反应、释放热量呢?
小明见妈妈买了些取暖袋,他很好奇,打开了一袋,发现里面是黑色的粉末.那么,取暖袋里是什么物质在发生反应、释放热量呢?| NaCl溶液 | Na2SO4溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 无明显变化 | 无明显变化 | 现象Ⅰ |
| 加入BaCl2溶液 | 无明显变化 | 产生白色沉淀 | 产生白色沉淀 |
| 加入AgNO3溶液 | 产生白色沉淀 | 溶液略呈浑浊 | 产生淡黄色沉淀 |
| 序号 | 加入试剂及操作 | 没有使用的暖袋 | 失效后的暖袋 |
| I | 加入足量水观察 | 无色溶液,大量固体在烧杯底部 | 无色溶液,大量固体在烧杯底部 |
| Ⅱ | 取I中上层清液,向其中滴加盐酸 | 无变化 | 无变化 |
| Ⅲ | 取I中上层清液,向其中滴加BaCl2溶液 | 无变化 | 无变化 |
| Ⅳ | 取I中上层清液,向其中滴加AgNO3溶液 | 白色沉淀 | 白色沉淀 |
| Ⅴ | 另取黑色粉末加入足量盐酸 | 大量气泡,溶液呈浅绿色 | 无气泡,溶液呈黄色溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
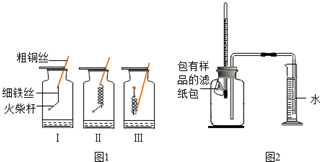
| 序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
| 1 | 1g铁粉、0.2g碳和10滴水 | 100 | 72 | 约120 |
| 2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 72 | 约70 |
| 3 | 1g铁粉和10滴水 | \ | \ | \ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com