
分析 锌和稀盐酸反应生成氯化锌和氢气,由质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应锌的质量,进而计算出这种锌粒的纯度.
解答 解:由质量守恒定律,生成氢气的质量为4g+80g-83.9g=0.1g.
设参加反应的锌的质量为x
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.1g
$\frac{65}{2}=\frac{x}{0.1g}$ x=3.25g.
这种锌粒的纯度为$\frac{3.25g}{4g}$×100%=81.25%.
答:这种锌粒的纯度为81.25%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:解答题
 如图在电解水实验中
如图在电解水实验中查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3g | 2g | 1.2g | m g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
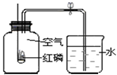
| A. | 实验中产生大量白雾 | |
| B. | 燃烧匙中的红磷可以换成木炭 | |
| C. | 本实验可以证明空气含有N2、O2、CO2和稀有气体 | |
| D. | 选用过量红磷是因为反应可以耗尽氧气,生成固态的P2O5 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com