
����Ŀ����ѧ���������������ء�
��1���ҹ��ܴ��Ϳͻ�C919��ʹ���˴�������þ�Ͻ�����Ʒ�ڿ����в��ױ���ʴ�����������ұ�������������ԭ����_____���û�ѧ����ʽ��ʾ����
��2������ͭ�������ճ������нӴ��������ֽ�����ͬѧ���������������ʵ������֤���ǵĽ������ǿ������ ������������Һ����ͭ����������Һ����ͭ����������Һ��ͬѧ����Ϊ��һ������ʵ�� ______�������������������������������Բ�����Ҳ����֤���������Ļ��ǿ������д��ʵ����е�ʵ������______��
��3���й��Ϻ������д����Ŀ�ȼ����CH4��nH2O����
�� ��ȼ���У�ˮ�����γ�һ�ֿռ���״�ṹ�����������N2��CO2�ȷ����������ڿ�϶�У��̶��Ļ�ѧ������ϵ����˿�ȼ������________��ѡ���������������������������
�ڼ�����һ������������ȼ�գ���÷�Ӧǰ������ʵ��������±���ʾ��
���� | ���� | ���� | ˮ | ������̼ | һ����̼ |
��Ӧǰ����/g | 3.2 | 11.2 | 0 | 0 | 0 |
��Ӧ������/g | 0 | 0 | 7.2 | 4.4 | δ�� |
���ݱ��������ݣ�����ɼ�����һ������������ȼ�յĻ�ѧ����ʽ _______��
��4��ij�������÷����������м��Ӧ��ȡ�������������Ƶ�FeSO4 1.52 t����Ҫ�������������Ƕ��٣����ڴ����д��������̣�_______
���𰸡�4Al+3O2=2A12O3 �� ��Һ����ɫ����ɫ����ͭ�ı���������ɫ�������ʲ��� ����� 4CH4 + 7O2 ![]() 2 CO2 +2 CO + 8H2O 0.56t
2 CO2 +2 CO + 8H2O 0.56t
��������
��1������Ʒ�ڿ����в��ױ���ʴ����Ϊ��������е�������Ӧ���������ܵ���������Ĥ�����������������ڲ�����𱣻����ã��ʷ�Ӧ�Ļ�ѧ����ʽдΪ��4Al+3O2=2A12O3��
��2��ʵ���У�ʵ�����ͭ����������Һ����Ӧ��˵�����Ļ��ǿ��ͭ��ʵ�����ͭ����������Һ��Ӧ�û�������˵��ͭ�Ļ��ǿ�����������ֽ����Ļ��ǿ��˳��ΪAl>Cu>Ag������ʵ��ٿ��Բ���������٣�
ʵ�����ͭ����������Һ��Ӧ���۲쵽����������Һ����ɫ����ɫ����ͭ�ı���������ɫ�������ʲ�����������Һ����ɫ����ɫ����ͭ�ı���������ɫ�������ʲ�����
��3���ټ��������N2��CO2�ȷ����̶��Ļ�ѧ������ϵ��˵����ȼ������ɲ��̶������ȼ��Ϊ�����������
�ڸ��������غ㶨�ɿ�֪������һ����̼������Ϊ3.2g+11.2g7.2g4.4g=2.8g����Ӧ�м��顢������������̼��һ����̼��ˮ�ķ��Ӹ�����Ϊ![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() =4��7��2��2��8���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��4CH4 + 7O2
=4��7��2��2��8���ʷ�Ӧ�Ļ�ѧ����ʽдΪ��4CH4 + 7O2 ![]() 2 CO2 +2 CO + 8H2O��
2 CO2 +2 CO + 8H2O��
��4���⣺����Ҫ��������Ϊx
Fe+H2SO4=FeSO4+H2��
56 152
x 1.52t
56��152=x��1.52t
x=0.56t
����Ҫ��������Ϊ0.56t��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ش�����
���18-A��18-B��������ѡ1����������������𣬰�18-A�Ʒ֡�
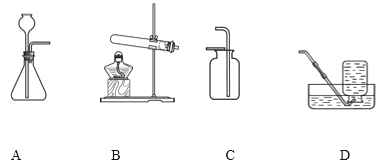
18-A | 18-B |
(1)ʵ������ȡCO2�Ļ�ѧ����ʽ��______�� (2)��Cװ���ռ�CO2�������ռ����ķ�����______�� | (1)ʵ�����ø��������ȡO2�Ļ�ѧ����ʽΪ______�� (2)��ΪO2��������ˮ��������______(�����)װ���ռ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�С��Ϊ�ⶨij�������Ʒ������صĺ�������ȡ2.00g����Ʒ�����ȣ��ռ��������������ڸ������²������������뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ����֪��

��2KClO3![]() 2KCl+3O2����
2KCl+3O2����
�ڸ��������������ܶ�Ϊ1.40g��L-1��
����Ʒ�е����ʲ����뻯ѧ��Ӧ��
���㣺
��1����ȫ��Ӧ�����������������Ϊ_______g��
��2����Ʒ������ص������Ƕ���_______?(д��������̣����������С�������λ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ŀǰʹ����㷺�Ľ�������ش��������⡣
(1)����һ��ȱ�����ܻ��еļ�����__________��
(2)��ҵ��������Ҫ�豸��_________����ҵ��ѡ�ó�����(��Ҫ�ɷ�Fe2O3)Ϊԭ�������Ļ�ѧ��Ӧ����ʽΪ_________��
(3)�������������(Cr) ,��(Ni)�ĺϽ𣬳���������ҽ����е���;ߵȡ�ͨ��ʵ���֪�����������ֽ���������ϡ���ᷴӦ�����������ֱ�õ������(CrSO4)��������(NiSO4)��Һ����д����(Cr)��ϡ���ᷴӦ�Ļ�ѧ����ʽ_______________��
(4)���������Ҫ����Ϊ![]()
��.д��ת���ٵĻ�ѧ����ʽ_________________��
��.ת��������![]() ����x��______________(xΪ����)��
����x��______________(x����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������֮Դ������Ȼ������Ҫ�����ʡ�
��1����ͼ��ij��Ȫˮ�ı�ǩ�е�һ���֡�

����д����ǩ����������Ҫ���������ѧ������
þ����________ ��������� _______
�ڸ���Ȼ��Ȫˮ���ض�ͯ���������Ϻÿ������Ȫˮ�е�_____Ԫ���йأ���������������____Ԫ�أ����������������
�۸ÿ�ȪˮΪ______����������������
��2������ˮ����������������ͼ��
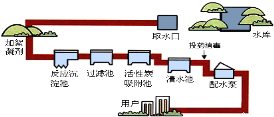
�������н�Ӳˮ���������ķ�����_____��
�ڡ�Ͷҩ��������һ����______ �仯�������������ѧ������
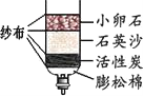
�����ƾ�����������ͼ�����õ�����̿����Ҫ��������_______�ԣ�ʯӢɳ��С��ʯ��������________��
��3�����ˮ��ͼʾ���£�
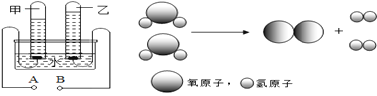
���ˮͨ����ֱ���磬ͼ��������____ �ˣ��A������B������ �����������__ �����ȼ�ԡ�����ȼ�ԡ�������90gˮ�м���4g�������ƣ�NaOH����������_______�����ǰ��Һ����Ԫ�ص�����Ϊ_______g��������Һ���������Ƶ���������_______����������С�����䡱����д�����ˮ�Ļ�ѧ����ʽ____________ ���ܹ�����������ѧ���ʵ���С���������е� ________ ������ĸ����
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������һ��ʵ�飺��ˮ����ͨ��һ���պ��ǹ�ܣ�������һ�����塣ͬѧ�Ƕ����ʵ��ܸ���Ȥ���������ͼ��ʾ��װ�ý���̽������Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ�������Fe��ˮ�����ķ�Ӧʵ������ʯ���������²��ϣ�����ˮ������Ӧ����
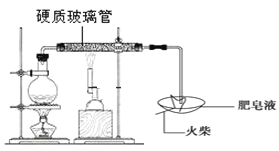
��1����Ӧһ��ʱ����з����ݴ���ʱ���õ�ȼ�Ļ�������ݣ��������б�����ʱ��˵��������ˮ�������ܹ����з�Ӧ������_____��д��ѧʽ����
��2��ʵ����ʯ����������_______��
��3��̽����������ʣ�����ɷ���ʲô��
���������ϣ�1.�������������������
�������������� | FeO | Fe2O3 | Fe3O4 |
��ɫ��״̬ | ��ɫ��ĩ | ����ɫ��ĩ | ��ɫ���� |
�ܷ������� | �� | �� | �� |
��ϡ���ᷴӦ | ����FeSO4 | ����Fe2(SO4)3 | ����FeSO4 ��Fe2(SO4)3 |
2.��������������Һ��Ӧ��������������
��������֤����������ʣ�����Ϊ��ɫ����ȫ��������������
����������裩����һ��ʣ�������Fe��Fe3O4���������ʣ�������_______��
��ʵ��̽����
ʵ����� | ʵ������ | ʵ����� |
���������е�ʣ�����ȡ���������Թ��У����������ϡ���ᡣ | �����ݲ��� | ______ |
����˼�뽻������ʣ������м��������ϡ��������������������_______����������������������ȷ��ʣ�����ɷ֣�ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��NaCl��KNO3���ܽ�����ߣ������й�˵���������( )

A. 0��ʱ�ܽ�Ƚϴ��������NaCl
B. 20��ʱ����ص��ܽ����31.6g
C. 50��ʱ������NaCl��Һ�����ʵ���������С�ڱ���KNO3��Һ�����ʵ���������
D. ��ȥKNO3�����л��е�����NaCl�ķ���Ϊ��������ˮ�ܽ⣬���ȵõ��ȱ�����Һ����ȴ�ᾧ���������Ȼ��ƹ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������֮Դ�����ڹ�ũҵ��������������;�㷺���������ѧ֪ʶ���ش��������⣺
��1��ˮ����_____���ɵģ����ˮ����Ԫ�صĻ��ϼ�_____��
��2������ˮ������ˮʱ��Ϊ�˳�ȥ���е�ɫ�غ���ζ���ʣ�ͨ����ˮ�м���_____����д�������ƣ���
��3�����Թ�ȡ����������ˮ�����벢����_____����ΪӲˮ��
��4������п�ڳ����·�Ӧ�ٶȺ����������뼸��ˮ��ʹ�÷�Ӧ���ң�ˮ�ڴ˴������ÿ�����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D���������dz�����ѧ������Ҫ���ʣ�B��C�����Ԫ����ȫ��ͬ�Ļ����A�ǹ��嵥�ʣ���һ�������£�Aȼ�տ�����B��C��D��ʵ������ȡC��ԭ�ϡ�����֮������ͼ��ʾ��ת����ϵ���������ʺͷ�Ӧ�����Ѿ���ȥ�����ɴ˿ɵó���
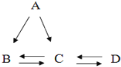
��1����D�ǹ���ҩƷ��������_______������д���ƣ�
��2��д��Cת��ΪD�Ļ�ѧ����ʽ______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com