
【题目】小华同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
(提出问题)金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
(猜想与假设)a.可能与盐酸的浓度有关;b.可能与反应时的温度有关;c.你的猜想是_____。
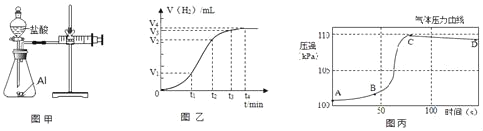
(设计并实验)小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的铝片进行如下实验。
实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
(交流讨论)(1)请写出铝与盐酸反应的化学方程式:_____。
(2)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是_____。
(分析数据、得出结论)
(3)实验中记录的数据可能是:_____;
对比实验②③可知_____ 对金属与酸反应的速率的影响
(4)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③.根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于_____两次实验所记录的数据之间。
(拓展延伸)
(5)小明进行铝与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳铝与稀盐酸反应速率的变化规律:_____
(6)研究小组同学对铝和稀盐酸的反应进行再探究。将橡皮塞连接气体压力传感器,烧瓶中放入铝片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如丙图所示的气体压强与时间的关系曲线图。
AB段气体压力变化不明显的原因是:_____。
CD段气体压力逐渐下降的原因是:_____。
【答案】与金属与酸的接触面积 2Al+6HCl═2AlCl3+3H2↑ 检查装置气密性 相同时间内注射器中收集到气体的体积(或注射器中收集相同体积气体所用的时间) 盐酸的浓度 实验②与实验④ 开始由慢变快,一段时间后,由快变慢 铝表面的氧化铝先与盐酸反应 到C点,反应完成,气体体积最大,并且该反应放热,所以反应结束后,随着温度降低,气体体积减小,压力逐渐下降
【解析】
[猜想与假设]金属的种类、盐酸的浓度、反应时的温度、金属与酸的接触面积对金属与盐酸反应快慢可能都会产生影响;故填:与金属与酸的接触面积(答案合理即可);
[交流讨论](1)铝与盐酸反应生成氯化铝和氢气;故填:2Al+6HCl═2AlCl3+3H2↑;
(2)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是检查装置气密性;故填:检查装置气密性;
(3)该实验是比较化学反应速率,所以记录的数据是相同时间内注射器中收集到气体的体积或注射器中收集相同体积气体所用的时间;故填:相同时间内注射器中收集到气体的体积(或注射器中收集相同体积气体所用的时间);
实验②③反应温度相同、铝片的形状相同,只有酸的浓度不同,所以是探究盐酸的浓度对金属与酸反应的速率的影响;故填:盐酸的浓度;
(4)盐酸质量分数为10%,温度为25℃,则所记录数据应该介于实验②与实验④之间,故填:实验②与实验④;
(5)根据坐标中的曲线变化可以看出,反应开始由慢变快,一段时间后,由快变慢,这是因为锌与稀盐酸反应放出热量使温度升高,开始时温度升高对反应速率的影响较盐酸浓度变小对反应速率影响更大,一段时间后,盐酸浓度减小对反应速率的影响较温度升高对反应速率的影响更大,故填:开始由慢变快,一段时间后,由快变慢;
(6)铝在空气表面会生成致密的氧化铝薄膜,氧化铝会先与盐酸反应,随着时间的推移,盐酸的浓度会逐渐降低,所以AB段气体压力变化不明显的原因是:铝表面的氧化铝先与盐酸反应;CD段气体压力逐渐下降的原因是:到C点,反应完成,气体体积最大,并且该反应放热,所以反应结束后,随着温度降低,气体体积减小,压力逐渐下降;故填:铝表面的氧化铝先与盐酸反应;到C点,反应完成,气体体积最大,并且该反应放热,所以反应结束后,随着温度降低,气体体积减小,压力逐渐下降。


科目:初中化学 来源: 题型:
【题目】合成氨是人类科学技术上得一项重大突破,对社会发展与进步做出了巨大贡献.合成氨的工艺流程图 如下:
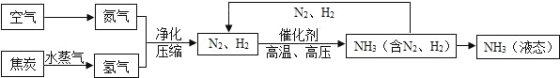
(1)合成氨需要的氮气来自空气,空气中氮气的体积分数约为_____.
(2)制取氢气的反应过程为:C+H2O![]() CO+H2,CO+H2O
CO+H2,CO+H2O![]() CO2+H2.上述两个化学方程式中表现 氧化性的物质是_____(填化学式).
CO2+H2.上述两个化学方程式中表现 氧化性的物质是_____(填化学式).
(3)原料中 N2、H2 中常含有 CO2 和水蒸气,反应前要净化.净化的过程是_____.
(4)写出 N2、H2 反应生成 NH3 的化学方程式_____.
(5)将沸点不同的气体分离开来,常采用液化分离法.如,控制温度在﹣183℃时,可将空气中 N2 与 O2分离.根据表中物质的沸点判断,要将产物 NH3 与 N2 、H2 分离开来,最适宜的温度应该控制在___℃
物质 | H2 | N2 | O2 | NH3 |
沸点 | ﹣252℃ | ﹣195.8℃ | ﹣183℃ | ﹣33.35℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某合金主要成分为Zn、Fe、Cu及这三种金属的少量氧化物。利用该合金制制成的机械零件废弃物制取高纯度ZnO,其部分工艺流程如图所示。请回答:
已知:Zn(OH)2溶于强碱形成可溶性盐。
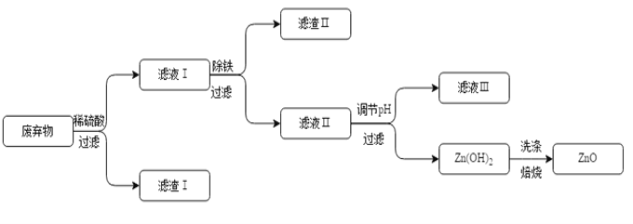
(1)滤渣I中一定有__________。
(2)加酸溶解废弃物时,需要通风并远离火源,其原因是__________。此过程中Zn还能起到除铜作用,除铜的化学方程式为__________,此反应属于__________(填基本反应类型)。
(3)调节pH可用NaOH,但不能过量,其原因是__________。
(4)焙烧Zn(OH)2发生分解反应的化学方程式为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有50mL稀硫酸的烧杯中,缓慢滴加一定溶质质量分数的氢氧化钡溶液至过量。随着氢氧化钡溶液的滴加,某些量变化趋势正确的( )
A.  B.
B. 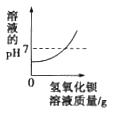 C.
C. 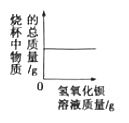 D.
D. 
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。已知:Sn+SnCl4=2SnCl2。
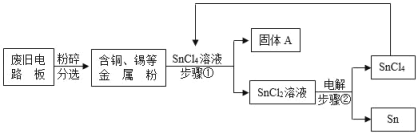
(1)步骤①的操作是_____。
(2)固体A中一定含有的金属元素是_____(填元素符号)。
(3)写出步骤②发生反应的化学方程式_____,该流程中可以循环利用的物质是_____。
(4)相比于直接焚烧废旧电路板回收金属,该工艺主要优点是_____(回答一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某地成功处置了一辆满载三氯化磷(PCl3)的车辆泄漏事故.三氯化磷是一种重要的无极工业产品,无色液体、密度1.574g/cm3 (21℃),熔点-112℃,沸点75.5℃,易燃.遇水反应生成亚磷酸(H3PO3)和氯化氢,与有机物接触会着火.下列对三氯化磷的说法错误的是( )
A. ![]() 中磷元素的化合价为
中磷元素的化合价为![]()
B. 运输途中应防雨淋和防高温
C. 运输过程中如果发生燃烧时,可以用水浇灭
D. 三氯化磷与水反应的化学方程式:![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钡是工业上一种重要的化工产品,以下是某工厂用含二氧化硅杂质的碳酸钡原料来生 产碳酸钡的工艺流程,请你根据流程回答下列问题:
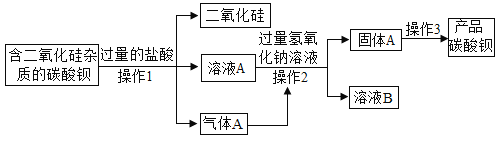
(1)生产流程中为节约成本,生成的气体 A 直接应用于流程中,其气体A是_______
(2)流程中溶液A中含有的溶质成分是________
(3)流程中溶液B中溶质的成分,可能的组合有_________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组利用下列装置进行气体的制取,请分析并填空.
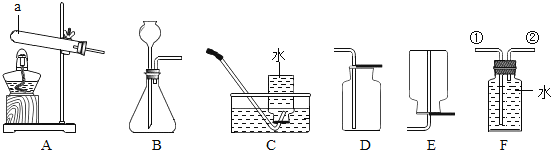
(1)写出图中仪器a的名称______;
(2)实验室用大理石和稀盐酸反应制取二氧化碳的化学方程式为______,应选择的收集装置为______(填字母);
(3)实验室用加热氯酸钾和二氧化锰混合物制取氧气,应选择发生装置为______(填字母);化学方程式为:______若用盛满水的F装置收集氧气,氧气应从导管______(填①或②)处通入F装置.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用硫铁矿烧渣(主要成分是Fe3O4、Fe2O3等)、煤粉作原料制备FeCO3的主要流程如图:
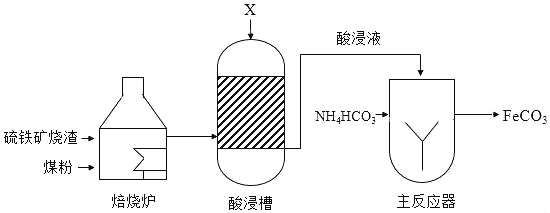
(1)焙烧炉中,发生的主要反应为:
①3C+2O2![]() 2CO+CO2
2CO+CO2
②Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
③Fe3O4+CO![]() 3FeO+CO2
3FeO+CO2
上述反应中的各物质,碳元素呈现_____种化合价.
(2)酸浸槽中,FeO转化为FeSO4,加入的物质X是_____.
(3)主反应器中,生成FeCO3的反应物为_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com