
【题目】某研究性学习小组利用下列装置进行气体的制取,请分析并填空.
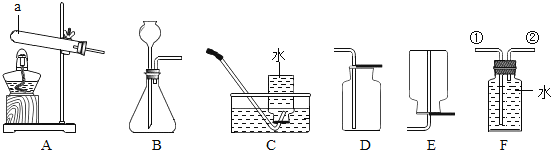
(1)写出图中仪器a的名称______;
(2)实验室用大理石和稀盐酸反应制取二氧化碳的化学方程式为______,应选择的收集装置为______(填字母);
(3)实验室用加热氯酸钾和二氧化锰混合物制取氧气,应选择发生装置为______(填字母);化学方程式为:______若用盛满水的F装置收集氧气,氧气应从导管______(填①或②)处通入F装置.
【答案】试管 CaCO3+2HCl=CaCl2+H2O+CO2↑ D A 2KClO3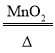 2KCl+3O2↑ ②
2KCl+3O2↑ ②
【解析】
熟悉常用仪器的名称、用途;根据实验室用大理石和稀盐酸反应制取二氧化碳的反应的原理写出反应的化学方程式;根据气体的密度和溶解性选择收集装置;反应物的状态和反应条件确定实验室制取氧气的发生装置;根据反应原理书写化学方程式;根据装置F的特点分析。
(1)由图示可知,仪器a的名称是:试管;故填:试管
(2)实验室用大理石和稀盐酸反应制取二氧化碳的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;因二氧化碳能溶于水,密度比空气大,应用向上排空气法收集,所以应选择的收集装置为D;故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;D
(3)实验室用加热氯酸钾(KClO3)和二氧化锰(MnO2)混合物制取氧气时,因是加热固体制取气体,所以应选用的发生装置是A,该反应的化学方程式是 2KClO3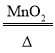 2KCl+3O2↑;因氧气的密度比水小得多,所以若用盛满水的F装置收集氧气,氧气应从导管②处通入F装置,水从①处排出;故填:A;2KClO3
2KCl+3O2↑;因氧气的密度比水小得多,所以若用盛满水的F装置收集氧气,氧气应从导管②处通入F装置,水从①处排出;故填:A;2KClO3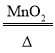 2KCl+3O2↑;②
2KCl+3O2↑;②


 名题金卷系列答案
名题金卷系列答案科目:初中化学 来源: 题型:
【题目】化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢质量分数。称量68 g过氧化氢溶液和0.1 g二氧化锰进行实验,反应前后质量随时间变化关系如图。计算:
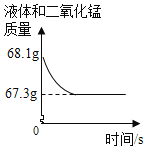
(1)制得氧气的质量是________g。
(2)过氧化氢质量分数是__________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小华同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
(提出问题)金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
(猜想与假设)a.可能与盐酸的浓度有关;b.可能与反应时的温度有关;c.你的猜想是_____。
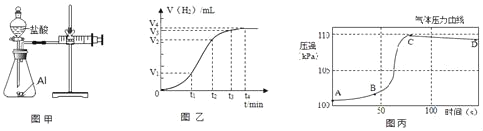
(设计并实验)小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的铝片进行如下实验。
实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
(交流讨论)(1)请写出铝与盐酸反应的化学方程式:_____。
(2)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是_____。
(分析数据、得出结论)
(3)实验中记录的数据可能是:_____;
对比实验②③可知_____ 对金属与酸反应的速率的影响
(4)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③.根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于_____两次实验所记录的数据之间。
(拓展延伸)
(5)小明进行铝与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳铝与稀盐酸反应速率的变化规律:_____
(6)研究小组同学对铝和稀盐酸的反应进行再探究。将橡皮塞连接气体压力传感器,烧瓶中放入铝片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如丙图所示的气体压强与时间的关系曲线图。
AB段气体压力变化不明显的原因是:_____。
CD段气体压力逐渐下降的原因是:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室用KClO3和MnO2制O2,反应后分离KCl和MnO2(难溶于水)。下列图示装置能达到实验目的是( )
A. 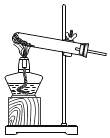 用此装置制取O2B.
用此装置制取O2B. ![]() 用此装置收集O2
用此装置收集O2
C. 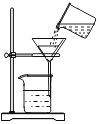 用此装置过滤D.
用此装置过滤D.  用此装置蒸发滤液
用此装置蒸发滤液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室以某石灰石(含少量Fe2O3)为原料制备高纯CaCO3的步骤如下。
溶解:向石灰石样品中加入适量盐酸,至反应完全。
除铁:加入氨水调节pH,然后加入适量Ca(OH)2,充分反应后过滤。
沉淀:向滤液中补充氨水,通入CO2,反应一段时间。
分离:过滤、洗涤、干燥得高纯CaCO3。
(1)溶解时,CaCO3、Fe2O3分别与盐酸反应的化学方程式为_____、_____。判断样品已完全反应的实验现象是_____。
(2)除铁时,选用Ca(OH)2而不选用NaOH,其主要原因是Ca(OH)2价格低且来源广、_____、_____;过滤所得滤渣的主要成分为_____。
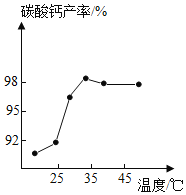
(3)沉淀时,其他条件相同,反应温度对CaCO3产率的影响如图。高于35℃时,CaCO3产率下降的主要原因是_____、_____。(已知:![]() ×100%)
×100%)
(4)分离时,若向过滤所得滤液中加入_____ (填化学式)并加热,则可回收NH3。
(5)该实验中可以循环利用的物质有H2O和_____。
(6)石灰厂煅烧石灰石生产CaO,若要得到28t CaO,则至少需要含CaCO3 90%的石灰石____吨。(写出计算过程,保留一位小数。)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为三种不同浓度的氢氧化钠溶液与对应浓度的盐酸反应的曲线。

下列说法正确的是
A. 在a、b、c三种曲线所示的实验中,所用盐酸浓度越大,V时所得溶液的pH越大
B. 在a曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由红色变为无色
C. 在a、b、c三种曲线所示的实验中,反应速率相同
D. 在a、b、c三种曲线所示的实验中,溶液酸性由强到弱的顺序是a>b>c
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有家用食用碱12g(主要成分Na2CO3,其它成分不与酸反应),向其中加入某未知浓度的稀盐酸100g,恰好完全反应,剩余物质的总质量为107.6g,反应过程如图所示,请计算:
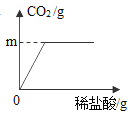
(1)该图中,m的值为____;
(2)该稀盐酸中溶质的质量分数为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2016年1月29日《科技日报》报道:科学家首次将从空气捕获的二氧化碳用氢气将其转化为甲醇,同时有水生成。该研究即可除去大气中的温室气体二氧化碳,生成的甲醇还能作为汽油的替代燃料。二氧化碳转化成甲醇的过程中,一个关键的因素是找到合适的均相催化剂。此次研究人员开发出在高温下不会分解的金属钌催化剂,稳定性好,可重复使用。
(1)图1是科学家正在研究的二氧化碳循环利用技术:
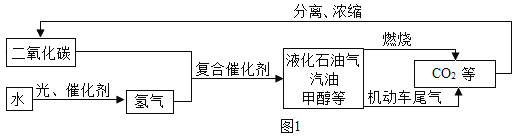
①二氧化碳与氢气在催化剂、高温条件下,除生成甲醇(CH4O)外,还生成一种常温下为液态的化合物,写出反应的化学方程式_____,甲醇中碳元素的化合价为_____。
②从图中分析得出的下列结论中,正确的是_____。(填序号)
A 该技术符合低碳经济的理念
B 水生成氢气的过程中所用的催化剂一定是二氧化碳
C 该技术有助于缓解全球面临的能源危机
D 液化石油气、汽油、甲醇均由碳、氢、氧三种元素组成
(2)在加油站贴有“严禁烟火”的标志的原因是_____,试从微观角度解释:_____。
(3)二氧化碳转化成甲醇的微观示意图,如图2所示。
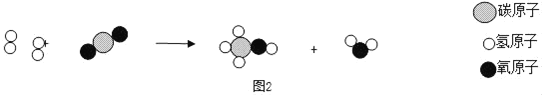
①该反应生成物中的化合物有_____种,其中属于氧化物的是_____(写出化学式)。
②请写出甲醇完全燃烧的化学方程式_____。
③下列关于催化剂的说法正确的是_____。(用序号作答)
a.能改变化学反应的速率,自身的质量不变;
b.反应过程中,自身的性质不变;
c.反应过程中,自身的化学性质不变;
d.能加快化学反应的速率,自身的质量不变。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定含有氯化钾和碳酸钾的化肥中氯化钾的含量,取5g混合物和11.1%的氯化钙溶液做如下实验:
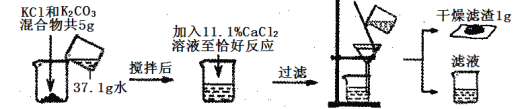
(1)写出上述反应的化学方程式_____;
(2)请列出能与氯化钙反应的物质的质量(x)的比例式_____;
(3)该化肥样品中氯化钾的纯度为_____;
(4)过滤后,最终滤液中溶质的质量分数为_____;
(5)若按上述过程用此化肥样品100t,可以生产出纯净的氯化钾_____t。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com