
| A. | 可作钾肥 | B. | 由三种元素组成 | ||
| C. | K2CO3属于盐类 | D. | 碳元素的化合价是+2价 |
科目:初中化学 来源: 题型:选择题
| A. | 用金刚石钻探机的钻头 | |
| B. | 用小苏打作焙制糕点的发酵粉 | |
| C. | 用甲醛浸泡海鲜防止其变质 | |
| D. | 用含氢氧化镁的药物治疗胃酸过多症 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
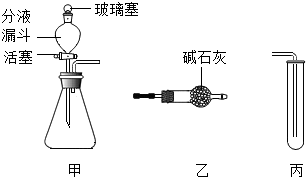 将图所示甲、乙、丙装置进行不同的组合,可以完成不同的实验,其中涉及的物质为初中化学常见物质.(提示:碱石灰的主要成分是CaO和NaOH)
将图所示甲、乙、丙装置进行不同的组合,可以完成不同的实验,其中涉及的物质为初中化学常见物质.(提示:碱石灰的主要成分是CaO和NaOH)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 归类 | 物质(或元素) |
| A | 常见合金 | 黄铜、硬铝、青铜 |
| B | 常见的干燥剂 | 浓硫酸、生石灰、碱石灰 |
| C | 常见复合材料 | 钢筋混凝土、聚乙烯塑料、玻璃钢 |
| D | 人体中常见微量元素 | 碘、锌、硒、铁等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 甲、乙两个化学兴趣小组的同学为测定某地石灰石的质量分数(杂质不参与反应),分别设计方案并进行实验.
甲、乙两个化学兴趣小组的同学为测定某地石灰石的质量分数(杂质不参与反应),分别设计方案并进行实验.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
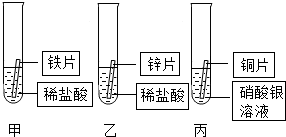 某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).
某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com