
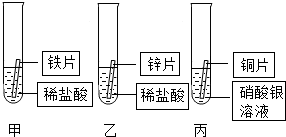
 某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).
某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同).分析 (1)根据金属的表面常有一层金属氧化物会影响金属和溶液的反应分析;
(2)根据铁与酸反应的现象分析;
(3)根据金属与酸反应产生气泡的速率可以判断金属的活动性强弱,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.(4)根据甲乙丙中得到的结论分析.
解答 解:(1)因为金属的表面常有一层金属氧化物会影响金属和溶液的反应,因此实验前用砂纸打磨金属片的目的是除去金属表面的氧化膜,利于反应;
(2)铁和稀盐酸反应生成氢气和浅绿色的氯化亚铁,所以反应现象为:故填:有气泡产生,铁片逐渐溶解;溶液由无色变为浅绿色;
(3)由于锌与稀盐酸反应放出气泡的速率比铁与稀盐酸反应放出气泡的速率快.所以,锌的活动性比铁强.由于铜的活动性比银强.能及将银从其溶液中置换出来.所以,铜片表面有银白色固体附着.
(4)通过上述实验,能比较出锌的活动性大于铁,铜的活动性大于银.还不能比较铁与铜的活动性.所以,要证明四种金属的活动性顺序,应增加的实验是将铁片投入到硫酸铜溶液中.
故答为:(1)除去金属表面的氧化膜,利于反应;
(2)有气泡产生,铁片逐渐溶解;溶液由无色变为浅绿色
(3)强;慢;银白;
(4)B.
点评 金属活动性顺序的应用主要表现在两个方面:一是只有排在氢前面的金属才能与酸反应,生成氢气和盐(位置越靠前,反应越剧烈),二是金属与盐溶液的反应时,只有排在前面的金属才能将排在它后面的金属从它的盐溶液中置换出来.


科目:初中化学 来源: 题型:选择题
| A. | 可作钾肥 | B. | 由三种元素组成 | ||
| C. | K2CO3属于盐类 | D. | 碳元素的化合价是+2价 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
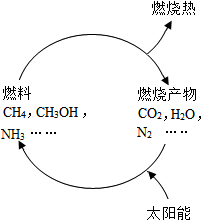 (1)从能源是否可以循环再生的角度看,可以将能源分为可再生能源和不可再生能源,譬如煤、石油、天然气就是不可再生能源.日益严峻的能源危机促进了可再生能源的研究.有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为热能.
(1)从能源是否可以循环再生的角度看,可以将能源分为可再生能源和不可再生能源,譬如煤、石油、天然气就是不可再生能源.日益严峻的能源危机促进了可再生能源的研究.有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为热能.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 食盐溶于水后,溶质以离子的形式存在 | |
| B. | 将少许泥土加入水中,搅拌后得到浑浊的液体 | |
| C. | 在75%的消毒酒精中,溶质是酒精,溶剂是水 | |
| D. | 用洗头膏洗去头发上的油污,利用了溶解作用 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com