
【题目】请根据下列装置图,回答有关问题:
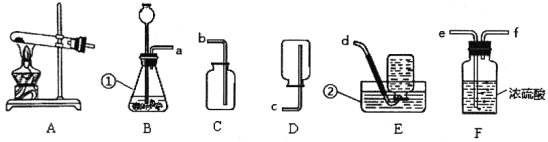
(1)写出图中标号仪器的名称:①___________②____________;
(2)写出用氯酸钾制取氧气的化学方程式______________________;
(3)做铁丝在氧气中燃烧的实验时,需要先打磨铁丝,目的是____________;
(4)用向上排空气法收集氧气时,验满的方法是_____________;
(5)实验室要干燥二氧化碳气体,气体应从F装置的_____________ (填“e”或“f”)管口通入。实验室制取二氧化碳的化学方程式为_____________;
(6)实验室用亚硫酸钠固体和浓硫酸反应制取二氧化硫,已知二氧化硫易溶于水,可在图中选用的发生装置和收集装置的组合是_________ (填字母)。
【答案】锥形瓶水槽2KClO3![]() 2KCl+3O2↑将铁锈除去,使实验顺利进行将带火星木条放在瓶口,若观察到带火星木条复燃,则氧气集满eCaCO3+2HCl=CaCl2+H2O+CO2↑BC
2KCl+3O2↑将铁锈除去,使实验顺利进行将带火星木条放在瓶口,若观察到带火星木条复燃,则氧气集满eCaCO3+2HCl=CaCl2+H2O+CO2↑BC
【解析】
(1)①为锥形瓶;②为水槽。
(2)氯酸钾制取氧气的条件为二氧化锰作催化剂加热,故反应的化学方程式为2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
(3)铁丝放置在空气中,容易和氧气、水蒸气反应生成铁锈,故做铁丝在氧气中燃烧的实验时,需要先打磨铁丝,将铁锈除去,使实验顺利进行。
(4)用向上排空气法收集氧气时,验满的方法是将带火星木条放在瓶口,若观察到带火星木条复燃,则氧气集满,反之未满。
(5)实验室进行气体洗气时,要长管进,短管出,故应将气体应从F装置的e管口通入;实验室制取二氧化碳采用大理石或石灰石(主要成分为碳酸钙)与稀盐酸反应,生成氯化钙、水和二氧化碳,故化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑。
(6)反应物为固体亚硫酸钠和液体浓硫酸,故发生装置选择B;二氧化硫易溶于水,不能采用排水法,二氧化硫的化学式为SO2,其相对分子质量为64,空气平均相对分子质量为29,因此二氧化硫的密度大于空气,故采用向上排空气法,收集装置选择C。故填BC。


科目:初中化学 来源: 题型:
【题目】科学家用通电的方法使水分解,从而证明了水的组成。
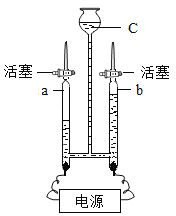
(1)把水注入水电解器装置中,接通直流电,可以观察到b管中的电极上________;随着反应的进行,c管中液面逐渐________(填写“升高”、“下降”或“不变”)。
(2)在实际实验操作中,我们会在水中加入少量氢氧化钠溶液或稀硫酸,其目的在于________。
(3)检验b管中气体产物的方法是________,检验a管中气体产物的方法是________。
Ⅰ.慢慢打开活塞,用燃着的木条靠近玻璃管尖嘴部分,观察是否被点燃,并用一干冷烧杯罩在火焰上方,观察现象
Ⅱ.用一支小试管收集生成的气体后移至酒精灯火焰处点燃,听是否有爆鸣声,并观察现象
Ⅲ.用带火星的木条接近玻璃管尖嘴部分,慢慢打开活塞,观察是否复燃
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列微粒符号中,对“2”含义的理解正确的是( )
A. 2Cu中的“2”表示2个铜元素
B. ![]() 中的“2”表示每个亚铁离子带有2个单位的正电荷
中的“2”表示每个亚铁离子带有2个单位的正电荷
C. ![]() 中的“2”表示1个硫化氢分子中含有2个硫原子
中的“2”表示1个硫化氢分子中含有2个硫原子
D. ![]() 中化学式上方的“2”表示硫元素为
中化学式上方的“2”表示硫元素为![]() 价
价
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合下列实验装置,回答问题。
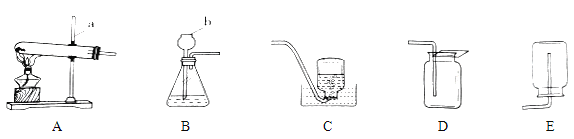
(1)写出仪器a和b的名称:a_____,b______。
(2)加热氯酸钾和二氧化锰的混合物制取氧气,该反应的化学方程式为_________。
(3)用石灰石和稀盐酸制取并收集二氧化碳,选用的装置为_______(填字母代号)。
(4)与集气瓶配套使用的玻离片一般一面为光滑面,另一面为磨砂面,收集气体时用玻璃片的___________盖好集气瓶(选填“光滑面”或“磨砂面”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
Ⅰ、吕布兰法
1789年,法国医生吕布兰(N.Leblanc,1742—1806)以食盐、浓硫酸,木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如下:

(1)碳酸钠俗称______。
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为______。
(3)③中“水浸”时通常需要搅拌,其目的是______。
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处______。
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,2NaHCO3![]() Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
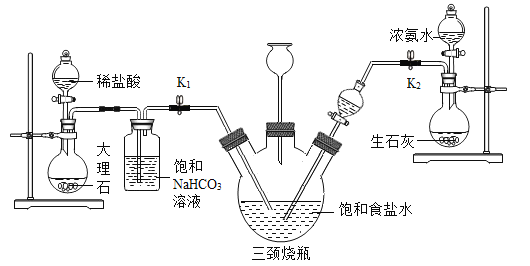
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(5)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为______。
(6)三颈烧瓶上连接的长颈漏斗的主要作用是______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通一段时间
CO2,其目的是______。
(7)根据实验记录,计算t2时NaHCO3固体的分解率______(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程。若加热前NaHCO3固体中还存在少量NaCl,上述计算结果将_____(填“偏大”、“偏小”或“无影响”)。
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布于众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的候氏制碱法。下列认识或理解正确的是______。
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的作用率,它符合当今“绿色化学”的理念。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有硫酸钠和氯化钠的固体混合物30g,加316.6g水使之全部溶解,将300g氯化钡溶液分三次加入该溶液中,实验数据记录如下表:
第1次 | 第2次 | 第3次 | |
加入氯化钡溶液质量/g | 100 | 100 | 100 |
生成沉淀的质量/g | 23.3 | m | 46.6 |
(1)表中m的数值是_______。
(2)原固体混合物中硫酸钠的质量分数是多少_______?(计算结果精确到0.1%)
(3)恰好完全反应时,所得溶液中溶质的质量分数的多少______?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲和乙两种固态物质的饱和溶液中溶质质量分数与温度的关系如图8所示。下列说法不正确的是

A. 甲和乙两种物质的溶解度随温度的升高而增大
B. t1℃时,甲和乙两种物质的溶解度相等
C. t1℃时,甲和乙两种物质溶液的溶质质量分数相等
D. 25g乙物质完全溶于100g水中所需的最低温度是t2℃
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】随着经济的发展,能源和环境成为人们日益关注的问题.
(1)煤、石油、天然气是生活中经常使用的燃料,其中天然气是较清洁的燃料.写出天然气主要成分燃烧的化学方程式________;
(2)燃煤发电时将煤块粉碎成煤粉,这样做的目的是什么?________
(3)化石能源的储量是有限的而且是不可再生的.化石燃料的燃烧都会产生二氧化碳,它是引起“温室效应”的气体.下列措施中有利于降低大气中二氧化碳含量的是________
A、植树造林,增大植被面积
B、用压缩天然气代替汽油作机动车燃料
C、将二氧化碳变废为宝,循环利用.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用工业碳酸钙(含有少量Al2O3、Fe2O3)生产医药CaCl22H2O的主要流程如下:
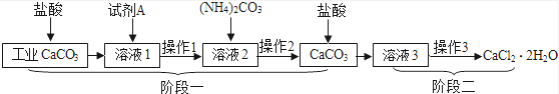
(1)加入试剂A的目的是除去溶液1中少量AlCl3、FeCl3 . 试剂A可以选择________(选填序号).
a.Na2CO3 b.Ba(OH)2 c.Ca(OH)2
(2)阶段一的目的是________ .
(3)操作1、2中,所用玻璃仪器有________、玻璃棒、烧杯、胶头滴管.操作3包括:蒸发浓缩、________、过滤、洗涤等.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com