【答案】
分析:(1)碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,根据化学方程式的书写方法可以写出该反应的化学方程式.
(2)由于反应只生成二氧化碳一种气体,因此固液混合物减少的质量就是生成二氧化碳的质量.
由二氧化碳的质量根据化学方程式可以可以找出二氧化碳与碳酸钠之间的质量关系,进而列出碳酸钠和二氧化碳之间有关质量关系的比例式.
(3)由上述比例式可以计算出碳酸钠的质量,该质量与样品质量的百分比,即为样品中碳酸钠的质量分数.
(4)由化学方程式还可以找到二氧化碳与氯化钠之间的质量关系,进而列出氯化钠和二氧化碳之间有关质量关系的比例式,再由比例式计算出生成氯化钠的质量,该质量即为所得溶液中的溶质质量.样品质量加上稀盐酸的质量,去掉杂质质量,去掉生成气体的质量,再加上加入水的质量即为所得溶液的质量.根据溶质质量分数的计算公式,可以计算出所得溶液中的溶质质量分数.
(5)由化学方程式可以找到二氧化碳与氯化氢之间的关系,进而列出氯化氢和二氧化碳之间有关质量关系的比例式,再由比例式计算出氯化氢的质量,结合稀盐酸的质量,根据质量分数的计算公式可以计算出稀盐酸中氯化氢的质量分数.
配制稀盐酸过程中溶质质量不变:稀释前浓盐酸中氯化氢质量=稀释后稀盐酸中氯化氢的质量.根据上述关系可以计算出浓盐酸的质量.
解答:解:(1)碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳.
该反应的化学方程式为:Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
(2)生成二氧化碳的质量为20g+100g-115.6g=4.4g
设样品中碳酸钠的质量为x,100g稀盐酸中氯化氢的质量为y,生成氯化钠的质量为z.
Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑
106----73---117-------44
x------y-----z--------4.4g
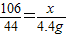
(3)x=10.6g
该样品中碳酸钠的质量分数为
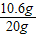
×100%=53%
(4)
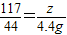
,z=11.7g
所得不饱和溶液中溶质的质量分数为
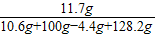
×100%=5%
(5)
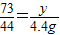
,y=7.3g
稀盐酸中溶质的质量分数为
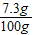
×100%=7.3%
所需浓盐酸的质量为300g×7.3%÷43.8%=50g
故答案为::(1)Na
2CO
3+2HCl=2NaCl+H
2O+CO
2↑;(2)
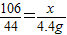
;(3)53%;(4)5%;(5)50g
点评:本题主要考查有关化学方程式的计算、溶质质量分数的计算和溶液的稀释计算.
有关化学方程式的计算的突破口是必须找出一种反应物或一种生成物的质量,根据该质量,可以计算出其它反应物或生成物的质量.
有关溶质质量分数的计算必须要注意两点:一、反应前各物质的质量和去掉不反应的杂质的质量,去掉生成沉淀和气体的质量,所得结果就是所得溶液的质量.二、按照溶质质量分数的计算公式进行计算.
溶液的加水稀释计算中的关键依据是溶质质量不变.

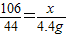
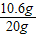 ×100%=53%
×100%=53%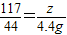 ,z=11.7g
,z=11.7g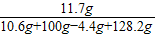 ×100%=5%
×100%=5%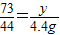 ,y=7.3g
,y=7.3g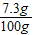 ×100%=7.3%
×100%=7.3%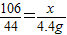 ;(3)53%;(4)5%;(5)50g
;(3)53%;(4)5%;(5)50g

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案