
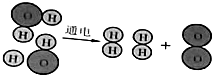
 水通电分解的示意图,据图回答下列问题.
水通电分解的示意图,据图回答下列问题.| 反应物 | 生成物 | ||
| H2O | O2 | ||
| A | 18g | 2g | |
| B | 8g | 64g | |
| 质量比 | |||
分析 (1)根据反应前后原子个数不变;
(2)根据化学反应中原子不变,分子中类改变;
(3)根据表中信息填空;
(4)化学反应都遵循质量守恒定律.
解答 解:(1)由图示可知,通电前,两个水分子中共含有4个氢原子,2个个氧原子,通电后有4个氢原子和2个氧原子.
(2)水通电分解过程中,原子的种类不变,各种原子的数目不变,而分子的种类改变;
(3)
| 反应物 | 生成物 | ||
| H2O | H2 | O2 | |
| A | 18g | 2g | 16g |
| B | 72g | 8g | 64g |
| 质量比 | 9:1:8 | ||
| 反应物 | 生成物 | ||
| H2 | |||
| A | 16g | ||
| B | 72g | ||
| 质量比 | 9:1:8 | ||
点评 要熟悉电解水的实验现象和结论,要能根据图示信息解决一些相关问题,知道化学变化与物理变化的本质区别.


 阶梯计算系列答案
阶梯计算系列答案科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 现象 | 结论 |
| 取少量石蕊试液于试管中,逐滴加入反应后烧杯内的溶液. | 溶液变红 | 猜想3正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
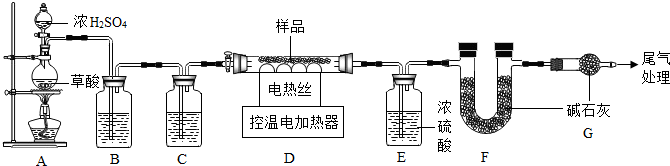
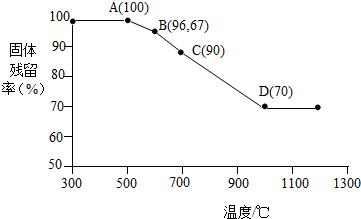
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com