
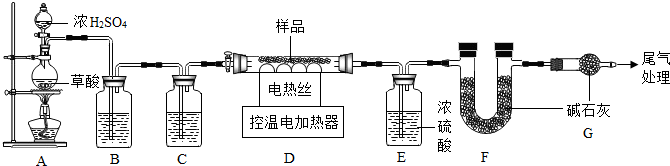
分析 (1)要熟悉各种仪器的名称、用途和使用方法;
(2)氢氧化钠能够吸收二氧化碳;
(3)一氧化碳和空气混合达到一定程度时遇明火会发生爆炸;
一氧化碳有毒,燃烧生成二氧化碳;
(4)浓硫酸能够吸收水蒸气,碱石灰能够吸收水蒸气和二氧化碳;
(5)空气中含有水蒸气和二氧化碳;
(6)根据图中提供的信息可以进行相关方面的计算和判断.
解答 解:(1)装配好实验装置后,首先要检查装置气密性.
故填:检查装置气密性.
(2)通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放氢氧化钠溶液,C中应该放浓硫酸.
故填:c.
(3)实验时,先点燃A处的酒精灯后开启控温电加热器的目的是排出装置中的空气,防止发生爆炸,尾气处理的方法是点燃,或利用塑料袋收集起来.
故填:排出装置中的空气,防止发生爆炸;点燃,或利用塑料袋收集起来.
(4)设碳酸亚铁质量为m,
装置F增重1.32g,说明碳酸亚铁分解生成了1.32g二氧化碳,装置E增重3.6g,说明铁锈中的结晶水的质量是3.6g,
FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑,
116 44
m 1.32g
$\frac{116}{m}$=$\frac{44}{1.32g}$,
m=3.48g,
Fe2O3•xH2O的质量为:22.52g-3.48g=19.04g,
根据题意有:Fe2O3•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+xH2O,
160+18x 18x
19.04g 3.6g
$\frac{160+18x}{19.04g}$=$\frac{18x}{3.6g}$,
x=2,
故填:3.48;2.
(5)若缺少G装置,空气中的水蒸气和二氧化碳能被F装置吸收,导致二氧化碳质量偏大,从而导致测得的FeCO3的质量偏大;
FeCO3的质量偏大,能够导致Fe2O3•xH2O质量偏小,从而导致x的值会偏大.
故填:偏大;偏大.
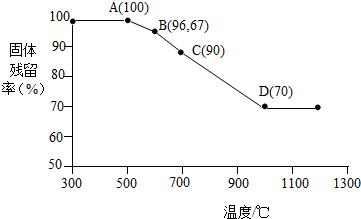
(6)假设氧化铁的质量是100g,
氧化铁中铁元素质量为:100g×$\frac{112}{160}$×100%=70g,氧元素质量为:100g-70g=30g,
AB段中,一氧化碳和氧化铁反应生成二氧化碳和铁的氧化物,B点时固体减少的质量即为氧化铁中氧元素损失的质量,减少的氧元素质量为:100g-96.67g=3.33g,
设B点时固体的化学式为FezOy,
根据题意有:$\frac{56z}{16y}$=$\frac{70g}{30g-3.33g}$,
$\frac{z}{y}$=$\frac{3}{4}$,
因此图中B点固体的成份为Fe3O4;
C点时减少的氧元素质量为:100g-90g=10g,
设C点固体的成份的化学式为FenOp,
根据题意有:$\frac{56n}{16p}$=$\frac{70g}{30g-10g}$,
$\frac{n}{p}$=$\frac{1}{1}$,
因此图中C点固体的成份为FeO,
CD段的化学式方程式为:FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.
故填:Fe3O4;FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 天天向上口算本系列答案
天天向上口算本系列答案科目:初中化学 来源: 题型:填空题
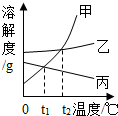 如图为甲、乙、丙三种固体物质在水中的溶解度曲线,请回答
如图为甲、乙、丙三种固体物质在水中的溶解度曲线,请回答查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 表示分子个数的是① | B. | 表示分子中原子个数的是② | ||
| C. | 表示元素化合价的是③ | D. | 表示离子所带电荷数的是④ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
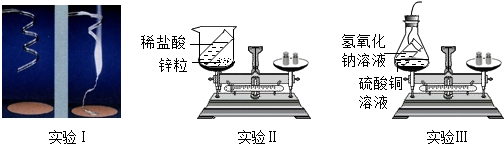
| 编号 | 实验I | 实验II | 实验III |
| 反应前/g | 4.8 | 112.6 | 118.4 |
| 反应后/g | 8.0 | 112.4 | 118.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
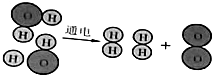 水通电分解的示意图,据图回答下列问题.
水通电分解的示意图,据图回答下列问题.| 反应物 | 生成物 | ||
| H2O | O2 | ||
| A | 18g | 2g | |
| B | 8g | 64g | |
| 质量比 | |||
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 工业三废的任意排放 | B. | 植树造林,修建水库 | ||
| C. | 农药和化肥的广泛使用 | D. | 生活垃圾和污水的任意倾倒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com