
| A. | 把食品放入冰箱中低温贮藏 | |
| B. | 调节燃气灶的进风口使天然气燃烧更充分 | |
| C. | 在铁制品表面刷上防锈漆 | |
| D. | 往保存粮食的仓库中通入适量氮气 |
分析 根据加快反应速度的因素有:使反应物接触面积增大,在燃烧时可增大可燃物与氧气的接触面积,或者增大氧气的浓度.铁生锈条件是与空气中氧气和水共同作用,然而喷漆是隔绝了氧气,就减缓了铁生锈的速度,升高温度会加速分子(原子或离子)的运动速度,所以反应接触面积就大了,反应速度就快了.
解答 解:A、冰箱保存食物使利用低温不利于细菌的繁殖,减慢了食物变质,反应速度慢了,故A错误;
B、调节燃气灶的进风口提供了足量的氧气使天然气燃烧更充分,使反应速度加快,故B正确;
C、铁制品表面喷漆使铁与氧气隔绝,减慢了反应速度,故C错误;
D、往保存粮食的仓库中通入适量氮气,由于氮气化学性质稳定,减慢了粮食变质的速度,故D错误.
故选B.
点评 反应速度加快的实质是反应物的接触面积增大,反应速度就快.


 智慧小复习系列答案
智慧小复习系列答案科目:初中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 甲 | 离子 | 茎 | 氧化反应 | 原子核 |
| 乙、丙、丁 | NH4+、K2MnO4、Na+ | 树皮、韧皮部、木质部 | 呼吸作用、铁生锈、塑料老化 | 质子、电子、中子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
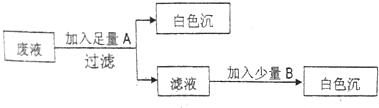
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
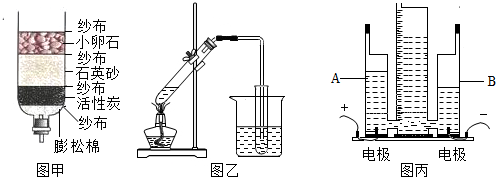
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 锌 | B. | 镁 | C. | 铜 | D. | 铝 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
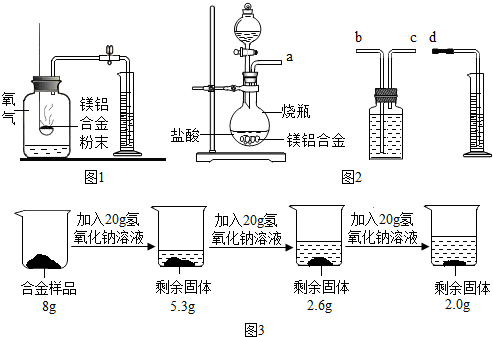
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com