
 某化学兴趣小组用如图所示装置研究以下两个问题.
某化学兴趣小组用如图所示装置研究以下两个问题.

科目:初中化学 来源: 题型:
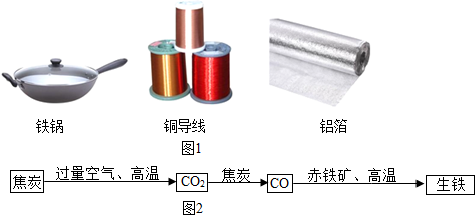
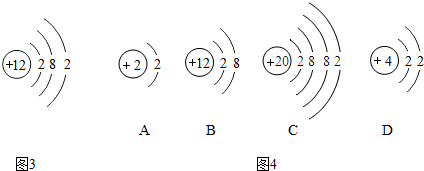
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、氧化物 | B、酸 | C、碱 | D、盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验装置 | 实验步骤 | 实验现象 |
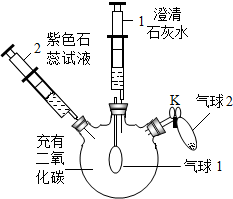 | ①向外拉注射器1 | 气球1微微鼓起, 注射器1中溶液变浑浊 |
| ②将注射器2中的液体推入瓶中 | 气球1继续微微鼓起, … | |
| ③打开K,将气球2中的固体氢氧化钠倒入瓶中后,关闭K | 气球1继续变大, … |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第三次 | |
| 加入稀盐酸的质量/g | 11.25 | 36.1 | 40.9 |
| 生成气体的质量/g | 2.2 | 4.4 | 4.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:
 现有A、B、C、D、E五种物质,分别为铁、氧化钙、盐酸、氢氧化钙和硫酸铜中的一种.
现有A、B、C、D、E五种物质,分别为铁、氧化钙、盐酸、氢氧化钙和硫酸铜中的一种.查看答案和解析>>
科目:初中化学 来源: 题型:
| 合金 | 合金的主要性能 | 主要成分及纯金属的性能 |
| 焊锡 | 熔点183℃ | 锡:熔点232℃;铅:熔点327℃ |
| 硬铝 | 硬度好 | 铝、铜、镁等.硬度小 |
| 不锈钢 | 抗腐蚀性好 | 铁、碳、铬、镍等.纯铁抗腐蚀性不如不锈钢 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 水和溶液在生产、生活中起着十分重要的作用.
水和溶液在生产、生活中起着十分重要的作用.| 物质 | A | B | C | D | 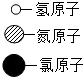 |
| 化学式 | NH3[来源:] | Cl2 | N2[来源:] | ||
| 微观示意图 |  |  |  |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com