
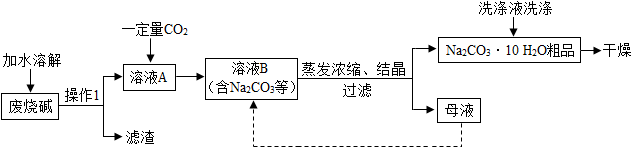
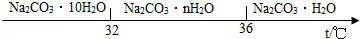
分析 【问题讨论】
(1)根据氢氧根离子和镁离子会生成氢氧化镁沉淀,碳酸根离子和钙离子会生成碳酸钙沉淀进行分析;
(2)根据操作I分离出的物质进行分析;
(3)根据题中所给的资料,碳酸氢钠和氯化钡的反应进行分析;
(4)根据碳酸钠的饱和溶液在不同温度下会析出不同的晶体进行分析;
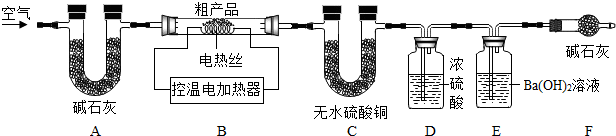
(5)①根据有气体参加或生成气体的反应,在反应前需要检验装置的气密性进行分析;
根据题中需要检验的物质进行分析;
②根据碳酸钠晶体、碳酸氢钠在270℃以上都会分解进行分析;
③根据加热到36℃时分解的产物进行分析.
解答 解:【问题讨论】
(1)通过转化关系中的物质可以看出,滤渣中除了氢氧化钠和氯化镁生成的氢氧化镁沉淀,还有碳酸钠和氯化钙生成的碳酸钙沉淀,滤渣主要成分为Mg(OH)2和CaCO3,氢氧化钠和氯化镁反应会生成氢氧化镁沉淀和氯化钠,所以产生Mg(OH)2的化学方程式为:2NaOH+MgCl2=2NaCl+Mg(OH)2↓;
(2)经过操作I分离出了液体和固体,所以操作I是过滤,过滤时需要的玻璃仪器有:烧杯、玻璃棒、漏斗;
(3)通过分析题中所给的资料,可知碳酸氢钠和氯化钡反应会生成二氧化碳气体,而题中加入氯化钡后,验证了溶液B中含NaHCO3,所以观察的现象是:出现气泡;
(4)通过碳酸钠的饱和溶液在不同温度下析出晶体的图示可以看出,温度高于32℃时,会析出Na2CO3•nH2O、Na2CO3•H2O,所以结晶后,过滤时的温度须低于32℃;
(5)①有气体参加或生成气体的反应,在反应前需要检验装置的气密性,否则会对检验的数据造成影响,所以实验前先要检验装置的气密性,
通过分析反应装置,可以看出无水硫酸铜是检验生成物中是否有水的,氢氧化钡是检验二氧化碳的,如果B装置左端直接通空气,空气中的二氧化碳、水会对实验造成干扰,所以装置A是作用是吸收空气中的二氧化碳和水蒸气;
②当粗产品加热至270℃,碳酸氢钠受热会生成二氧化碳,二氧化碳和氢氧化钡反应会生成白色的碳酸钡沉淀,粗产品加热至270℃,据E中产生白色沉淀,可知粗产品中含NaHCO3,
碳酸钠晶体分解也会生成水,碳酸氢钠分解也会生成水,所以测得C,D共增加m1是两部分水的质量,E质量增加m2是碳酸氢钠分解产生的二氧化碳的质量,
通过2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑可以看出,碳酸氢钠分解生成的水和二氧化碳的质量比是9:22,所以m1:m2>9:22,
设混合物中碳酸氢钠为x,
2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
168 44
x 1.1g
$\frac{168}{44}$=$\frac{x}{1.1g}$
x=4.2g
通过方程式可以看出碳酸氢钠的质量为4.2g,所以实验测得m2=1.1g,则可推算32.8g粗产品中含有NaHCO3的质量为:4.2g,故32.8g粗产品中Na2CO3•10H2O的质量分数为:$\frac{32.8g-4.2g}{32.8g}$×100%≈87.2%;
③加热到36℃时,碳酸氢钠不会分解,通过②中的计算可知碳酸氢钠为4.2克,所以粗产品中含有碳酸钠晶体为32.8g-4.2g=28.6克,
纯碳酸钠为:28.6g×$\frac{106}{286}$=10.6克,
当加热至36℃时,测得B中剩余固体27.4g,碳酸氢钠为4.2克,碳酸钠晶体为23.2克,
所以$\frac{106}{106+18n}$×23.2g=10.6g
n=7
所以该剩余固体是Na2CO3.7H2O和和NaHCO3的混合物.
故答案为:(1)CaCO3;2NaOH+MgCl2=2NaCl+Mg(OH)2↓;
(2)漏斗;
(3)出现气泡;
(4)32;
(5)①检查装置气密性;吸收空气中的二氧化碳和水蒸气;
②E中产生白色沉淀;
设混合物中碳酸氢钠为x,
2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
168 44
x 1.1g
$\frac{168}{44}$=$\frac{x}{1.1g}$
x=4.2g
通过方程式可以看出碳酸氢钠的质量为4.2g,所以实验测得m2=1.1g,则可推算32.8g粗产品中含有NaHCO3的质量为:4.2g,故32.8g粗产品中Na2CO3•10H2O的质量分数为:$\frac{32.8g-4.2g}{32.8g}$×100%≈87.2%;
③Na2CO3•7H2O.
点评 在解此类题时,首先分析题中所给的资料,然后结合学过的知识和题中的转化关系图对每个问题进行逐一的分析解答,难度较大,能很好考查学生对知识的掌握和应用能力.


科目:初中化学 来源: 题型:选择题
| A. | 氢原子结合形成氢气 | |
| B. | 物质在不同条件下的三态变化主要是由于分子的大小发生了变化 | |
| C. | 气体易被压缩,说明构成气体的分子在不断运动 | |
| D. | 原子的质量主要集中在原子核上 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 环境问题不容忽视!国家环保总局向媒体发布2007年“六•五”世界环境日中国主题--“污染减排与环境友好型社会”,并发布了主题标识.下列措施与世界环境日中国主题不相符合的是( )
环境问题不容忽视!国家环保总局向媒体发布2007年“六•五”世界环境日中国主题--“污染减排与环境友好型社会”,并发布了主题标识.下列措施与世界环境日中国主题不相符合的是( )| A. | 白色污染:少用塑料制品 | |
| B. | 赤潮:使用无磷洗衣粉 | |
| C. | 酸雨:燃煤脱硫,工厂废气净化达标再排放 | |
| D. | 臭氧层空洞:大力推广含氟致冷剂,如:氟里昂 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 化学符号 | $\stackrel{+3}{Fe}$ | 2Mg | P | 3N2 | Ag |
| 表示意义 | +3价的 铁元素 | 2个镁原子 | 磷元素 | 3个氮分子 | 单质银 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 反应前 | 反应后 |
| 石灰石样品质量6.0克 | 杯内物质总质量 63.8克 |
| 稀盐酸质量60.0克 | |
| 烧杯质量100.0克 | 烧杯质量100.0克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com