
| A. | 氢原子结合形成氢气 | |
| B. | 物质在不同条件下的三态变化主要是由于分子的大小发生了变化 | |
| C. | 气体易被压缩,说明构成气体的分子在不断运动 | |
| D. | 原子的质量主要集中在原子核上 |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
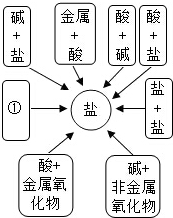 分类法是学习化学的重要思想方法.
分类法是学习化学的重要思想方法.| 不同类的物质 | 分类依据 | |
| 示例 | 水 | 水是氧化物,其余不是氧化物 |
| 分类一 | 食盐 | 常温下食盐是固体,其余是液体 |
| 分类二 | 醋酸 | 醋酸是酸,其余的不是酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
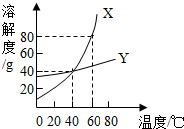 X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
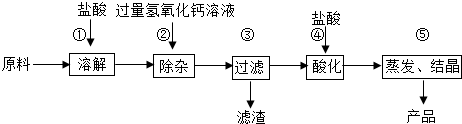
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 此反应为CO2的利用创造一种新的方法 | |
| B. | 此反应前后分子个数不变 | |
| C. | 此反应属于置换反应 | |
| D. | 此反应制取的CH4可以再利用 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
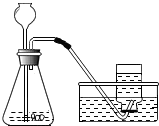 如图所示,老师在演示用过氧化氢和二氧化锰制取氧气的实验中,收集完氧气后,反应还在继续进行.小明同学认为,这个装置的缺点是不能控制反应随时发生、随时停止,造成了药品的浪费.
如图所示,老师在演示用过氧化氢和二氧化锰制取氧气的实验中,收集完氧气后,反应还在继续进行.小明同学认为,这个装置的缺点是不能控制反应随时发生、随时停止,造成了药品的浪费.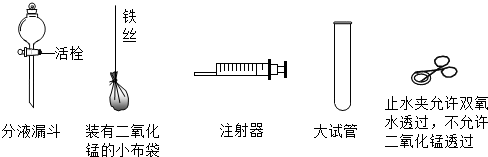
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
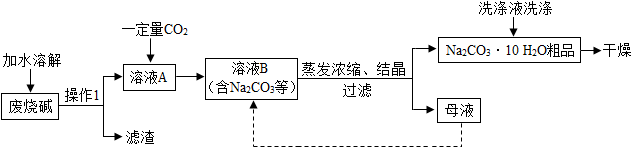
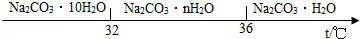
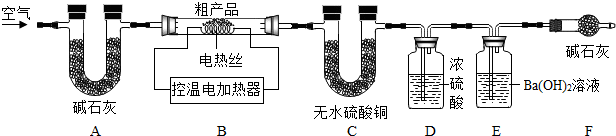
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com