
 如图所示是一瓶用排水法收集好的无色气体.据此,(除无色外)请你写出与这种气体相关的物理性质.
如图所示是一瓶用排水法收集好的无色气体.据此,(除无色外)请你写出与这种气体相关的物理性质.  优等生题库系列答案
优等生题库系列答案科目:初中化学 来源: 题型:解答题
| 实验操作步骤 | 实验现象 | 结论及解释 |
| 实验一:取其中一瓶的少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. | 实验过程中始终没有气泡产生. | 则证明此瓶中猜想Ⅰ成立. |
| 实验二:取另一瓶中的少量固体样品于试管中,加蒸馏水完全溶解,然后滴加少量氯化钡溶液. | 实验过程中产生 白色沉淀 | 则证明猜想Ⅱ或Ⅲ成立. 此过程中发生反应的化学方程式为BaCl2+Na2CO3═BaCO3↓+2NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
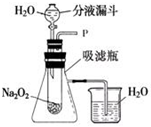 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe,一定不含Fe2O3. |
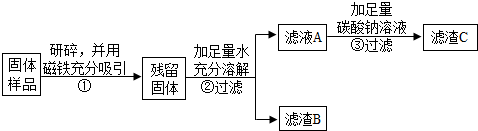
| 实验操作 | 实验现象 | 实验结论 |
| ①取滤渣B于试管中,加入适量稀盐酸 ②生成的气体通入澄清石灰水 | ①有气泡冒出 溶液变为黄色②该溶液变浑浊. | 固体中一定含有CaCO3和Fe2O3. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 正常人每天都应摄入一定量的蛋白质 | |
| B. | 做馒头时,常在发酵后的面团中加入适量的纯碱,使蒸熟的馒头疏松多孔 | |
| C. | 包装食品使用聚氯乙烯塑料袋,可以用加热的方法封口 | |
| D. | 厨房洗涤剂具有乳化功能,常用来除去餐具上的油污 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
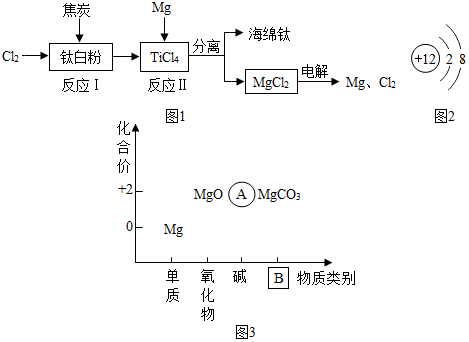
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na2CO3 NaCI NaOH | B. | NaOH NaCI Na2CO3 | ||
| C. | NaCI NaOH Na2CO3 | D. | NaCI Na2CO3 NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com