
化学兴趣小组为了测定石灰石中碳酸钙的质量分数(杂质不溶于水,也不与盐酸反应).测得的数据如下:
| 实验组次 | 1 | 2 | 3 | 4 |
| 样品质量/g | 30 | 20 | 20 | 30 |
| 稀盐酸的质量/g | 50 | 50 | 100 | 100 |
| 产生气体的质量/g | 6.6 | 6.6 | 6.6 | m |
(1)m的值为9.9;(2)2;(3)该石灰石样品的纯度为75%;
解析试题分析:(1)由表中数据可知50g盐酸或20g样品最多能生成6.6g二氧化碳,所以10g样品能生成3.3g二氧化碳,m为30g样品与100盐酸混合后生成的气体,由表中的数据可知30样品一定完全反应;
所以m=3.3×3=9.9;(2)由表中数据可知50g盐酸或20g样品最多能生成6.6g二氧化碳,所以可以得到第2组实验恰好反应;
(3)设20g石灰石中碳酸钙的质量为X
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 6.6g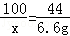
x=15g
该石灰石样品的纯度为: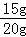 ×100%=75%
×100%=75%
考点:根据化学反应方程式的计算.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:计算题
为检查某石灰石样品中碳酸钙的纯度,取该样品24g放入烧杯中,再向烧杯中加入70g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余固体物质共85.2g,
(1)反应生成CO2的质量为 g;
(2)石灰石样品中碳酸钙的质量。
(3)石灰石样品中碳酸钙的质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。
(1)用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为:
(2)Fe2O3中铁元素的质量分数为:
(3)根据化学方程式计算:用含Fe2O360%的赤铁矿石800 t,理论上可炼出纯铁多少吨?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
将铜和氧化铜固体混合物粉末11.2g放入烧杯中,当加入稀硫酸100 g时,氧化铜与硫酸恰好完全反应.过滤后所得溶液的质量为108g,(不考虑过滤过程中溶液的质量损失).
(1)混合物中铜元素的质量分数为 (计算结果保留到0.1%)
(2)求稀硫酸中H2SO4的质量分数.(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
将148g氯化钙溶液与一定量的碳酸钠溶液混合,恰好完全反应.过滤后,得到20g沉淀和溶质质量分数10%的溶液.求:碳酸钠溶液中溶质质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
如图1是某试剂瓶标签上的内容.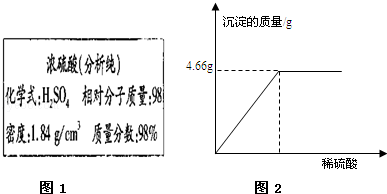
(1)要把10g这种浓硫酸稀释为20%的硫酸,需要水的质量为 39 g.在用量筒量取水时若是仰视读数,将导致稀释后的硫酸溶液质量分数 (“>”、“<”或“=”)20%
(2)试计算用上述稀释用的稀硫酸测定50gBaCl2溶液的质量分数,实验数据如图2所示,写出具体的计算过程.(已知:BaCl2+H2SO4=BaSO4↓+2HCl )
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室有瓶存放一段时间的氢氧化钠固体,部分已变质为碳酸钠.取2.00g该固体,先加水充分溶解,再加入足量澄清石灰水,生成1.00g碳酸钙沉淀.计算:
(1)2.00g该固体中碳酸钠的质量;
(2)该氢氧化钠固体的变质程度.(计算结果保留到1%)
(提示:氢氧化钠的变质程度是指已变质的氢氧化钠占变质前氢氧化钠的质量分数)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某同学将15.0g碳酸钙粉末置于250mL、87.0g的烧杯中,向其中加入105.4g某浓度的稀盐酸,充分反应后,称得烧杯及其剩余物的总质量为203.0g。则:
(1)反应生成的二氧化碳的质量为________________g;(1分)
(2)烧杯内各物质的名称分别为_________ __________;(2分)
(3)列式计算所得溶液的溶质质量分数。(3分)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某校兴趣小组同学收集到含有硝酸银的溶液10g,他们利用铁锌合金回收其中的金属银,其实验过程如图所示。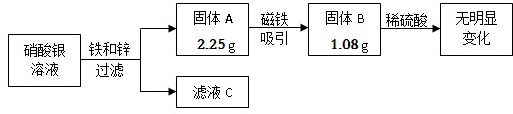
(1)固体A的成分是 (填化学式);滤液C中一定含有的溶质是 (填化学式)。
(2)写出铁与硝酸银反应的化学方程式: 。
(3)计算硝酸银的相对分子质量 ;原硝酸银溶液中溶质的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com