
【题目】由A和B两种元素组成的化合物中,已知A和B的元素质量比为21:8,而A和B的相对原子质量之比为7:2,则该化合物的化学式为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
科目:初中化学 来源: 题型:
【题目】图甲是实验室中一氧化碳还原氧化铁的装置示意图,图乙是工业上炼铁高炉示意图。下列叙述中正确的是
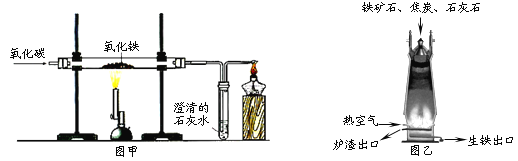
A. 按图甲进行实验,看到红棕色粉末变黑时立即停止通CO
B. 玻璃管中固体物质能被磁铁吸引,说明固体物质全部是铁
C. 工业炼铁中原料焦炭的作用是提供热量和CO2
D. 炼铁高炉的出铁口低于出渣口,是因为生铁的密度较大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图A、B、C三个集气瓶中分别盛有氧气、空气、二氧化碳中的某一种气体,分别将集气瓶按照如图方式倒扣住点燃后的蜡烛和白磷。
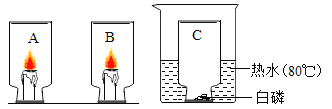
(1)A中的蜡烛会立即熄灭。
(2)B瓶中的蜡烛突然十分明亮,一段时间后,该蜡烛也渐渐熄灭,其熄灭的原因可能是____
A 氧气耗尽 B 温度降低 C 瓶内产生了二氧化碳 D 蜡烛着火点改变
(3)C瓶倒扣住足量的白磷后,再往烧杯中倒入80℃的热水,出现的现象是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,也是人类最宝贵的资源。
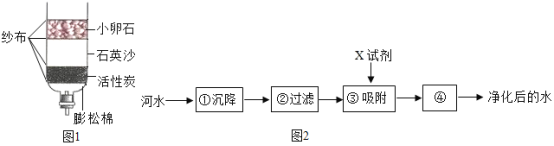
(1)下列各种水中,属于纯净物的是_________(填字母);
A汽水 B矿泉水 C蒸馏水 D经过净化处理的自来水
(2)饮用硬度过大的水不利于人体健康,因此人们常采用_________的方法将硬水软化;
(3)小刚为了净化收集到的雨水,自制了一个如图1所示的简易净水器,其中小卵石、石英砂和蓬松棉的作用是_________;
(4)自来水厂净化水的主要步骤如图2所示。有关说法错误的是_________。
A步骤①②可除去难溶性杂质
B X试剂可以是活性炭
C步骤④可用硫酸铜杀菌、消毒
D步骤①中可加入明矾作絮凝剂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】新药帕拉米韦(化学式为C15H28O4N4)注射液可用于治疗H7N9型禽流感。下列关于帕拉米韦的说法正确的是(相对原子质量:C—12、H—1、O—16、N—14)
A.帕拉米韦的相对分子质量为328 g
B.帕拉米韦是由15个碳原子、28个氢原子、4个氧原子、4个氮原子构成的
C.帕拉米韦是由碳、氢、氧、氮四种元素组成的
D.帕拉米韦中碳元素的质量分数为 ![]() ×100%
×100%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了二氧化锰对过氧化氢有催化作用的知识后。某同学想:氧化铜能否起到类似二氧化锰的催化剂作用呢?于是进行了如下探究。
(猜想)Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后_____和_____不变。
(实验)用天平称量0.2g氧化铜,取5mL 5%的过氧化氢溶液于试管中,进行如下实验:
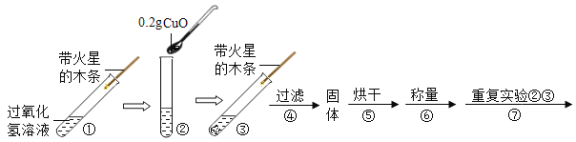
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_____, 带火星的木条复燃 | 所得固体 _____g | 溶液中有气泡放出, _____ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(2)步骤①的目的是_____。
(3)过氧化氢能被氧化铜催化分解放出氧气的化学反应的文字表达式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究燃烧的条件,某同学查阅资料得知:白磷为白色蜡状固体,剧毒,不溶于水,着火点为40oC;红磷的着火点为240oC。然后按下图所示A装置进行实验。
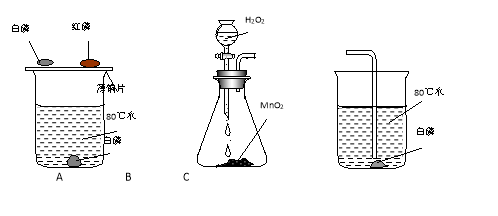
(1)观察到的现象为:铜片上的白磷和红磷分别是 ②水下的白磷 ;
(2)在使用组装好的B装置前,首先应该进行的操作是 ,然后加入药品并将B和C装置连接,滴入双氧水,B装置中反应的化学方程式为 ,C装置中的白磷燃烧。
(3)从以上实验分析可得出燃烧的条件为:可燃物、 和 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用化学知识,完成下列相关问题:
①在氮气、氧气、二氧化碳、二氧化硫气体中,在空气中体积百分含量为![]() 的气体是__________,造成“酸雨”的气体是_____________。(均用“化学式”表示)。
的气体是__________,造成“酸雨”的气体是_____________。(均用“化学式”表示)。
②水是人类宝贵的自然资源。
I.自来水净化中,常用__________作凝聚剂,使水中杂质沉降。
II.常温下,打开汽水瓶塞,有气泡冒出,说明气体溶解度与__________有关。
III.水电解时,连接电源负极的玻璃管内的气体具有的性质是__________(填序号)。
a.有色有味 b.能够燃烧 c.支持燃烧 d.易溶于水
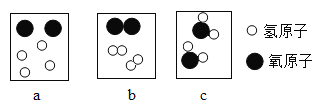
IV.下图是水通电后分解过程中微粒变化的部分示意图,请按它们在化学变化过程中出现的顺序排列__________(用图中的字母表示),其中元素以游离态存在的图示是__________。(填写图示序号)
V.除去水中难溶性杂质固体的操作是__________,其中玻璃棒的作用是__________;
VI.如图是淡化海水的模拟装置。
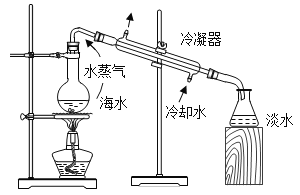
冷凝器中用水作冷却剂是利用其_____________。
a.水分子的缔合性 b.比热容大 c.分散性
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
(1)计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为______________ g,所需蒸馏水的体积为 _____________ mL(水的密度约为1g/mL).
(2)称量:分别在天平左右两盘放上纸片,调节平衡后,应_________ (填标号).
A 先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡.
B 先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡.
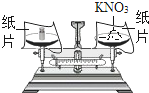
(探究一):在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 ________ (填“有”或“没有”)影响,理由是___________ .
(3)量取:准确量取所需蒸馏水要用到的仪器是_________(选填图中的标号).
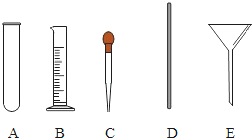
(4)溶解:将称量好的硝酸钾和蒸馏水混合溶解.
(探究二):20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为:_________ g/mL.
温度℃ 质量分数% | 20 | 40 | 60 |
4 | 1.023 | 1.016 | 1.007 |
10 | 1.063 | 1.054 | 1.044 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com