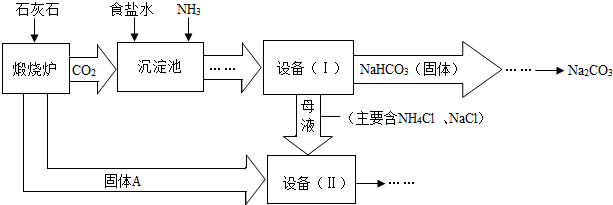
工业上可以用食盐和石灰石为原料制取纯碱(Na
2CO
3),生产的关键是在沉淀池中让 NaCl、NH
3、CO
2和H
2O尽可能多地转化成NaHCO
3(固体沉淀物)和NH
4Cl(溶液).主要生产流程如下:
(1)NaHCO
3俗称
小苏打
小苏打
,该物质受热分解成碳酸钠和两种氧化物,写出反应的化学方程式
,还可以用来治疗胃酸过多,反应方程式是
NaHCO3+HCl═NaCl+H2O+CO2↑
NaHCO3+HCl═NaCl+H2O+CO2↑
.
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是
过滤
过滤
.
(3)写出设备( II)中发生的复分解反应的方程式
Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2
Ca(OH)2+2NH4Cl═2NH3↑+2H2O+CaCl2
.
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
NaCl、NH3
NaCl、NH3
(填写化学式).
(5)某兴趣小组取80克石灰石样品进行煅烧实验(所含杂质在煅烧过程中不分解),测得反应后剩余固体的质量与时间的关系如下:
| 反应时间 |
T0 |
T1 |
T2 |
T3 |
T4 |
T5 |
T6 |
| 反应后固体的质量 |
80 |
75 |
70 |
66 |
62 |
58 |
58 |
请回答下列问题:
①石灰石完全反应后生成二氧化碳的质量为
22
22
克.
②该石灰石样品中碳酸钙的质量分数,写出计算过程.