
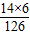 ×100%≈66.7%
×100%≈66.7% =0.15Kg
=0.15Kg

科目:初中化学 来源: 题型:
 (2009?江西)A、B、C、D、E五种物质均为初中化学中常见的化合物,它们之间的关系如图所示,相互之间连线表示能发生化学反应.A、C、E均为氧化物,A是人体呼出的主要气体;在实验室中B可以用来制取A,而D可以用来检验A;C和E反应能生成D.
(2009?江西)A、B、C、D、E五种物质均为初中化学中常见的化合物,它们之间的关系如图所示,相互之间连线表示能发生化学反应.A、C、E均为氧化物,A是人体呼出的主要气体;在实验室中B可以用来制取A,而D可以用来检验A;C和E反应能生成D.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/℃ 溶解度/g 物质 | 0 | 10 | 20 | 30 | 40 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com