
【题目】工业上利用含5%氢氧化钠的造纸厂废水来处理含硫酸铜为2%的炼铜厂废水,若现在要处理炼铜厂废水40t,则至少要造纸厂废水多少吨?
【答案】设40t炼铜厂废水可以反应氢氧化钠的质量为x
40t炼铜厂废水中含硫酸铜的质量为:40t×2%=0.8t
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
80 160
X 0.8t
80 :160 =X :0.8 t
X= 0.4 t
含0.4 t氢氧化钠的废水质量为:0.4 t/5% = 8 t
答:至少要造纸厂废水8 t。
【解析】解:40t炼铜厂废水中含硫酸铜的质量为: 40t×2%=0.8t
设40t炼铜厂废水可以反应氢氧化钠的质量为x
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
80 160
x 0.8 t
![]()
解得:x= 0.4 t
含0.4 t氢氧化钠的废水质量为: ![]() = 8 t
= 8 t
答:至少要造纸厂废水8 t。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:初中化学 来源: 题型:
【题目】实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴滴加到样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如下图所示。试回答:
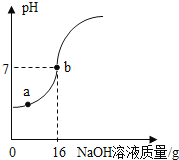
(1)a点溶液中含有的溶质有___________________________;
(2)途中b点表示的含义是:___________________________,此时消耗NaOH溶液中的NaOH的质量为_________g;
(3)计算稀H2SO4的溶质质量分数_____________。(写出计算过程,结果精确至0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
【提出问题】从废旧手机中可以回收到哪些有价值的金属?如何回收?
【查阅资料】
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
Ⅲ.2Cu + O2 + 2H2SO4 2CuSO4 + 2H2O
【实验方案】
第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:①它们的市场价格较高;②________________。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
II | 将金属电路放入烧杯中,加入过量稀盐酸浸泡 | …… |
III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。
| 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
V | …… | …… |
【问题讨论】
⑴ 由步骤I中的现象,可推知的焊锡的物理性质是________;
⑵ 步骤II对应的实验现象是________________;
⑶ 步骤II所得溶液中,至少含有溶质有______种;
⑷ 步骤V的操作是:“向步骤Ⅳ获得滤液中加入一定量铁粉”,若该实验过程加入铁粉前后溶液中主要离子变化示意图如图所示。
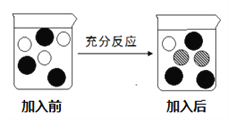
① 图中“![]() ”所代表微粒的符号为________;
”所代表微粒的符号为________;
② 充分反应后过滤,滤纸上固体物质是________(写化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有关水分子的叙述正确的是
A.水在固态时分子是静止不动的
B.保持水的化学性质的微粒是水分子
C.水由液态变成气态时水分子质量变小
D.水结冰后体积变大是水分子的体积增大造成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
反应前 | 反应后 | ||
实验数据 | 烧杯和过氧化氢溶液的质量/g | 硫酸铜溶液的质量/g | 烧杯和烧杯中溶液的质量/g |
60 | 3.3 | 62.5 | |
(1)生成氧气的质量为________.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定Na2CO3样品是否纯净,某同学称取11.4g样品放入烧杯中,向烧杯中加入73g稀盐酸.恰好完全反应后烧杯中剩余的总质量为80g(假设产生的气体全部逸出)(计算结果精确到0.1%).
(1)反应生成气体的质量为 g.
(2)样品中碳酸钠的质量是多少?
(3)所取稀盐酸中溶质质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】浩瀚的大海里蕴藏着丰富的资源,开发海水资源前景广阔。
海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.13 | 0.56 | ||||
1.20 | 0.91 | ||||
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(1)工业上利用太阳能进行海水晒盐。已知海水蒸发浓缩过程中析出盐的种类和质量如上表:(表中数据为每升海水在浓缩过程中析出各种盐的质量,单位为g)
①海水从密度为1.21g/ml浓缩到1.22g/ml时下列说法正确的是___________
A.各种盐的溶解度增大
B.海水中NaBr的质量分数不变
C.析出粗盐中NaCl的质量分数增大
D.海水中水的质量分数不变
②海水在浓缩过程中,最先析出的盐是__________。
(2)工业上利用粗盐水(含有少量CaCl2、MgCl2)生产纯碱,工艺流程如下图:
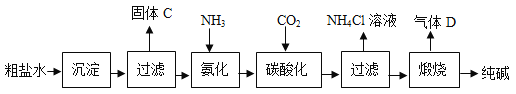
已知:ⅰ常温下,NH3极易溶于水,CO2能溶于水;
ⅱNaHCO3加热易分解,Na2CO3加热不易分解。
完成下列填空:
①粗盐水加入沉淀剂NaOH、Na2CO3分别除去MgCl2、CaCl2,固体C为__________;
②流程中,先“氨化”后“碳酸化”的目的是__________;
③“碳酸化”后过滤获得的NH4Cl可用作__________肥,也可先__________(填“加热”或“冷却”)NH4Cl溶液,再加入石灰水以循环使用的物质是__________;
④“煅烧”时,NaHCO3分解生成的气体D是__________,若将气体D直接排入空气不合理的理由是__________。
(3)海滨研究所以含有CaCl2、MgCl2的卤水和贝壳(主要成分为CaCO3)为主要原料在实验室制备无水CaCl2,流程如图1:

请回答下列问题:
①操作Ⅰ中用到的玻璃仪器有烧杯、玻璃棒、__________。
②以MgCl2为例写出卤水中除去Mg2+时发生反应的化学方程式__________。
③操作Ⅱ酸化时应选择的酸是__________(填写化学式)。
④上述反应中未涉及的基本反应类型是__________(填写字母)。
a.复分解反应 b.置换反应 c.化合反应 d.分解反应
⑤回收的CO2在紫外线照射和催化剂作用下能与水蒸气反应,生成甲烷和氧气,该反应的化学方程式为__________。紫外线照射时,在不同催化剂(①、②、③)的作用下,甲烷产量随光照时间的变化如图2所示,在第10小时时甲烷产量最高是__________(填写“①”、“②”、或“③”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com