
| 稀盐酸的质量 | 第一次 40g | 第二次 40g | 第三次 40g | 第四次 40g | 第五次 40g |
| 剩余固体质量 | 40g | ag | 20g | 10g | 5g |
分析 (1)根据第一次加入40g稀盐酸,导致固体由50g变成了40g,减少了10g,第三次也是有20g变成10g,说明每加入40g盐酸能够使固体减少10g,依据杂质不与盐酸反应,反应的是碳酸钙,结合方程式计算出所用稀盐酸溶质的质量分数,并据溶质的质量分数式分析解答;
(2)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,据此书写方程式;
(3)第5次加入40g盐酸,固体减少5g,说明样品中碳酸钙反应完毕,依据碳酸钙的总质量计算生成的二氧化碳的总质量,列出比例式;
(4)利用第二次实验所消耗碳酸钙的量,根据反应的化学方程式,计算出生成的氯化钙的质量,由溶质的质量分数公式,求出加入水后溶液中溶质的质量分数;
(5)由50g样品中杂质的质量是5g,计算样品中碳酸钙的纯度,并据碳酸钙分解的反应方程式计算需要大理石的质量
解答 解:(1)第一次加入40g稀盐酸,导致固体由50g变成了40g,减少了10g,第三次也是有20g变成10g,说明每加入40g盐酸反应10g碳酸钙,即a=40g-10g=30g;
(2)碳酸钙和盐酸反应方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)要求生成二氧化碳的总质量,则须求出所有碳酸钙反应生成的二氧化碳的质量,第5次加入40g盐酸,固体减少5g,说明样品中碳酸钙反应完毕,所以碳酸钙的总质量是50g-5g=45g
设45g碳酸钙与盐酸反应生成二氧化碳的总质量是X
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
45g X
则求解生成二氧化碳总质量的比例式是:$\frac{100}{44}=\frac{45}{X}$;
(4)第二次反应的碳酸钙的质量是20g,设生成的二氧化碳的质量是a,生成氯化钙的质量是b
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
20g b a
$\frac{100}{20g}=\frac{111}{b}=\frac{44}{a}$
b=22.2g
a=8.8g
所以向第二次反应后所得溶液的溶质质量分数是$\frac{22.2g}{20g+80g-8.8g}$×100%=24.3%;
(5)根据以上分析,该大理石中碳酸钙的质量分数是:$\frac{45g}{50g}$×100%=90%
设需要这种大理石的质量为n
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 56
n×90% 280t×(1-10% )
$\frac{100}{n×90%}=\frac{56}{280t×(1-10%)}$
n=500t
故答案为:
(1)30;
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)$\frac{100}{44}=\frac{45}{X}$;
(4)23.4%;
(5)500t.
点评 本题考查综合、全面,分析透彻每次加入40g稀盐酸固体剩余物质量的变化,对反应进行的情况进行判断,这是解决本题的基础,该题可很好考查学生分析、解决问题的能力,本题涉及的方程式计算较多,要找准已知量,细心分析.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 (1)空气的成分按体积百分数计算,大约是氮气占78%,氧气占21%,稀有气体占0.94%,二氧化碳占0.03%.
(1)空气的成分按体积百分数计算,大约是氮气占78%,氧气占21%,稀有气体占0.94%,二氧化碳占0.03%.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
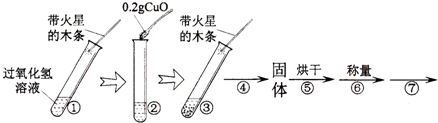
| 步骤③现象 | 步骤⑥结果 | 步骤⑦操作 | 结论 |
| 剧烈反应,有气泡产生,带火星的木条复燃 | 称量的氧化铜的质量仍为0.2g | 重复步骤溶液中有气泡放出,带火星的木条复燃 | 在过氧化氢溶液的分解反应中,氧化铜也能作催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | 未填 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com