
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
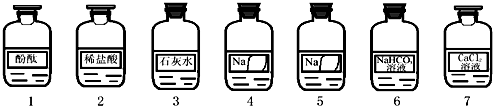
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量4号溶液于试管中,加入足量CaCl2溶液②向上层清液中滴加无色酚酞试液 | ①有白色沉淀生成②溶液由无色变成红色 | 4号溶液是部分变质的NaOH溶液. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
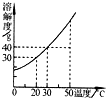 如图是某固体物质的溶解度曲线.
如图是某固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 它是一种能溶解于水的气体 | |
| B. | 降温加压下它可以变成固体“干冰” | |
| C. | 它不能燃烧也不能支持燃烧 | |
| D. | 它不能燃烧也不能支持燃烧,且通常状况下,它的密度比空气的密度大 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
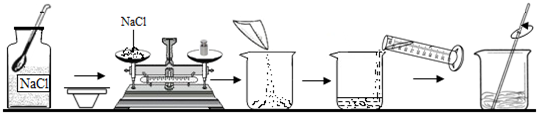
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com