
【题目】金属的性质
金属材料是现代生活和工农业生产中应用极为普遍的一类重要物质。请回答下列问题:
(1)请阅读以下信息,并将文中错误的描述标出:_______________ (填写序号)。
①金属都具有银白色金属光泽,②有良好的导电性和导热性。③汞是熔点最高的金属。④合金是由金属与其他金属或非金属熔合而成的,⑤合金是具有金属特性的纯净物,⑥合金一般比组成它的金属硬度大。
(2)大多数金属化学性质活泼,但活泼性有差异。例如,锌、铁、铝这三种金属与氧气或酸液等物质的反应的剧烈程度各有差异。请根据这三种金属的性质完成下面的表格。
反应现象描述 | 对应的金属 (化学式) | 构成该金属的粒子 (粒子符号) | 反应的化学方程式 | 基本反应类型 |
纯氧炉中火星四射 | _____ | _____ | _____ | _____ |
常温即形成致密氧化膜 | _____ | _____ | _____ | _____ |
与稀硫酸反应剧烈程度居中 | _____ | _____ | _____ | _____ |
(3)大多数金属暴露在空气中都易被腐蚀,请举两条防止金属锈蚀的措施:①____________;②____________。
回收重新冶炼是保护金属资源的一条有效途径。请写出用一氧化碳在高温条件下还原锈蚀钢铁(主要成分是Fe2O3)的化学方程式:__________________。
但有时我们也会利用锈蚀为生活服务,请写出下列金属的应用原理:
① 食品袋中的铁粉 ②
食品袋中的铁粉 ② 暖贴中的铁粉 ③
暖贴中的铁粉 ③ 暖气片上涂的铝粉
暖气片上涂的铝粉
①___________________ ;②________ ;③________________ 。
(4)从金属的原子结构看,金属易与其它物质发生反应的根本原因是________________。
【答案】 ①③⑤ Fe Fe 3Fe +2O2 ![]() Fe3O4 化合 Al Al 4Al+3O2 == 2Al2O3 化合 Zn Zn Zn+H2SO4=ZnSO4+H2↑ 置换 涂覆保护层 制成合金 Fe2O3+3CO
Fe3O4 化合 Al Al 4Al+3O2 == 2Al2O3 化合 Zn Zn Zn+H2SO4=ZnSO4+H2↑ 置换 涂覆保护层 制成合金 Fe2O3+3CO![]() 2Fe+3CO2 铁粉吸收氧气和水分,延缓食物变质 铁粉与氧气反应放出热量 铝粉氧化后形成致密氧化膜防止内部金属生锈 金属原子最外层电子数少于4个,在化学反应中易失去电子
2Fe+3CO2 铁粉吸收氧气和水分,延缓食物变质 铁粉与氧气反应放出热量 铝粉氧化后形成致密氧化膜防止内部金属生锈 金属原子最外层电子数少于4个,在化学反应中易失去电子
【解析】(1)①金属不一定都具有银白色金属光泽,例如铜为紫红色,错误;②金属有良好的导电性和导热性,正确;③汞常温下为液态,是熔点最低的金属,错误;④合金是由金属与其他金属或非金属熔合而成的,正确;⑤合金是具有金属特性的混合物,错误;⑥合金一般比组成它的金属硬度大,正确;
(2)铁在氧气中燃烧火星四射,铁由原子直接构成,化学式为Fe,铁在氧气中燃烧生成四氧化三铁,化学方程式为:3Fe +2O2 ![]() Fe3O4;该反应符合“多变一”的特点,属于化合反应;铝在空气中与氧气反应形成一层致密氧化铝膜,化学方程式为:4Al+3O2 == 2Al2O3;该反应符合“多变一”的特点,属于化合反应;铝由原子直接构成,化学式为Al;锌、铁、铝这三种金属中锌的活动性居中,与稀硫酸反应剧烈程度居中,锌由原子直接构成,化学式为Zn,锌与硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应,属于置换反应;
Fe3O4;该反应符合“多变一”的特点,属于化合反应;铝在空气中与氧气反应形成一层致密氧化铝膜,化学方程式为:4Al+3O2 == 2Al2O3;该反应符合“多变一”的特点,属于化合反应;铝由原子直接构成,化学式为Al;锌、铁、铝这三种金属中锌的活动性居中,与稀硫酸反应剧烈程度居中,锌由原子直接构成,化学式为Zn,锌与硫酸反应生成硫酸锌和氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑;反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应,属于置换反应;
(3)大多数金属暴露在空气中都易被腐蚀,防止金属锈蚀就要隔绝空气或改变金属的结构,所以防止金属锈蚀的措施有涂覆保护层、制成合金等;一氧化碳在高温条件下还原锈蚀钢铁(主要成分是Fe2O3)生成铁和二氧化碳,化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;①铁粉吸收氧气和水分,延缓食物变质;②铁粉与氧气反应放出热量;③铝粉氧化后形成致密氧化膜防止内部金属生锈;
2Fe+3CO2;①铁粉吸收氧气和水分,延缓食物变质;②铁粉与氧气反应放出热量;③铝粉氧化后形成致密氧化膜防止内部金属生锈;
(4)金属原子最外层电子数少于4个,在化学反应中易失去电子,所以金属易与其它物质发生反应。


 优加精卷系列答案
优加精卷系列答案科目:初中化学 来源: 题型:
【题目】下图所示为实验室常用的实验装置:

据此回答下列问题:
(1)写出带标号的仪器名称:①____________;
(2)常温下,实验室制取并收集纯净的氧气选择的装置组合是_________(填序号),化学方程式为_________ ,检查该装置组合中发生装置气密性的方法是__________
(3)F装置可用来测量生成的二氧化碳气体的体积,其中在上面放一层植物油的目的是________
(4)某同学在实验室用大理石与稀盐酸制取二氧化碳时,发现产生气体的速率太快,请你分析并写出可能的原因__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定钢铁中的含碳量,设计如下装置,钢铁样品在装置A中煅烧时,气体产物只有CO2和SO2。
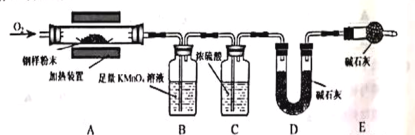
(1)钢样处理成粉末的主要目的是 。钢样中的Fe3C煅烧时的化学方程式为
Fe3C+3O2![]() +CO2
+CO2
(2)实验室用KClO3和MnO2制备O2的化学方程式为 ,MnO2中Mn的化合价为 。
(3)装置 B的作用是 ,装置 B中的现象是 。
(4)装置C的作用是 。若无装置C,则测定结果 (填“偏大”“无影响”或“偏小”)。
(5)装置D的作用为 ;装置E的作用为 .
(6)钢样中加入某物质可降低煅烧温度,为不影响测定结果,该物质在组成上需满足的条件是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图,对以下气体制备的发生装置说法正确的是( )
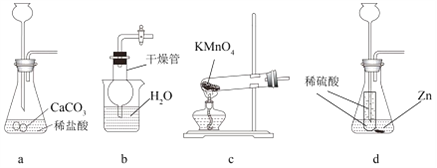
A. 装置 a 可作实验室制备二氧化碳
B. 装置 b 烧杯加水后,干燥管内外液面一致,则气密性良好
C. 装置 c 可用作高锰酸钾制备氧气
D. 装置 d 可作实验室制备氢气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图中 A—M 是我们初中常见的化合物,是由 H、C、N、O、S、Cl、Ca 元素组 成的;M 为常见的有机物,A、C、G 为氧化物,且 G 中两种元素质量之比为 5:2,其中 E 为人体胃液中的主要成分。图中“——”表示两端的物质能发生化学反应;“→”表示物质间存 在的转化关系;反应条件、部分反应物和生成物略去。
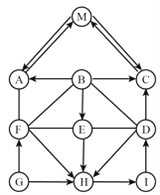
(1)物质 E 的化学式为____________;M 的名称为____________。
(2)G→F 为_________ 反应(填放热或吸热)。
(3)B→E 的反应方程式为______________ 。
(4)E 和 D 反应的方程式为______________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验小组用传感器探究稀氢氧化钠溶液与稀盐酸反应过程中温度和pH的变化,测定结果如图所示。下列说法正确的是

A. 实验中溶液的温度一直升高、pH一直增大 B. 氢氧化钠与盐酸的中和反应先放热后吸热
C. 40s时溶液中的溶质为氢氧化钠和氯化钠 D. 该实验是将稀氢氧化钠溶液滴入稀盐酸中
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】绿矾(FeSO47H2O)用途广泛,可用作净水剂,医学上可用作补血剂,还可用于制颜料。
(1)绿矾是一种絮凝剂,利用其溶于水后生成的胶状物对杂质的____________,使杂质沉降来达到净水的目的。
(2)缺铁会引起贫血,铁是一种人体必需的__________(填“常量元素”或“微量元素”)。
(3)《本草纲目》中记载,绿矾“煅过变赤,则为绛矾”。绛矾是古代壁画、彩塑中使用的一种红色颜料。
某化学兴趣小组同学对绿矾高温分解的产物很感兴趣,进行了如下探究。
(查阅资料)
①绿矾高温分解的产物是一种固态金属氧化物和几种气态非金属氧化物。
②在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。
③无水硫酸铜遇水变蓝。
④硫有两种常见的氧化物,部分性质如下表:
硫的氧化物 | 熔点 | 沸点 | 水溶性 | 能否使高锰酸钾溶液褪色 |
SO2 | -75.5℃ | -10℃ | 易溶于水 | 能 |
SO3 | 16.8℃ | 44.8℃ | 易溶于水 | 不能 |
(提出问题)
《本草纲目》中记载绿矾“煅过变赤”,经实验验证绿矾高温分解确实产生红色固体,说明绿矾高温分解产生的一种固态金属氧化物是____________,那么产生的几种气态非金属氧化物是什么呢?
(进行猜想)猜想1:H2O 和____________;
猜想2:H2O 和SO3 ;
猜想3:H2O、SO2和SO3 。
甲同学认为无需通过进一步实验即可判定猜想2错误,理由是_______________________。
(设计实验)
乙同学用以下装置检验绿矾高温分解产生的气态非金属氧化物:
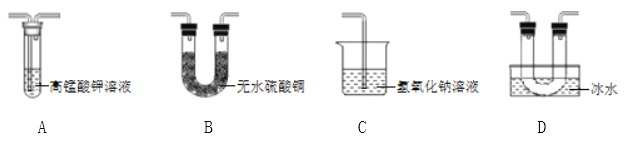
需将绿矾高温分解产生的气体依次通过______________(填字母,且每套装置限用一次)。
(分析现象)进行上述实验,观察到A中试管内溶液________,B中U形管内固体________,D中U形管内出现无色晶体,说明猜想3正确。
(得出结论)绿矾高温分解的化学方程式为_______________________________________。
(拓展延伸)生产硫酸最古老的方法是使绿矾高温分解,将生成的SO3和H2O同时冷凝并发生反应SO3+H2O=H2SO4 ,所以古代称硫酸为“绿矾油”。假定SO3和H2O全部冷凝并充分反应,SO2全部逸出,则通过这个方法得到的硫酸的质量分数为____________(计算结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是初中化学中常见物质间的转化关系,其中在通常情况下,F、G是组成元素相同的两种气体,Q是铁锈的主要成份,R是黑色固体(部分反应条件和生成物已略去),请回答下列问题:
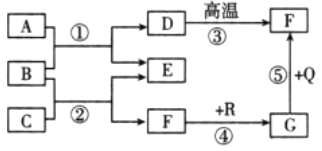
(1)G的化学式为____________________。
(2)若E是生活中常用的调味剂、防腐剂,则D的化学式为____________________。
反应②的化学方程式为________________________________________。
(3)反应⑤在工业生产中的用途为________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D四种元素,A元素形成的单质在常温下是最轻的气体。B元素形成的单质在常温下是无色气体,A和B可以形成A2B和A2B2两种化合物。B和C形成的化合物(气体)甲是形成酸雨的主要气体,A、B、C三种元素形成的化合物乙溶于水呈酸性。D是海水中含量最高的金属元素。根据以上信息回答下列问题:
(1)元素A为_________,D为_________。
(2)A、B、D三种元素形成化合物的化学式为____________,乙的化学式____________。
(3)A2B2在一定条件下可转变成A2B,请写出该反应的化学方程式_________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com