
【题目】根据下列实验装置图填空:
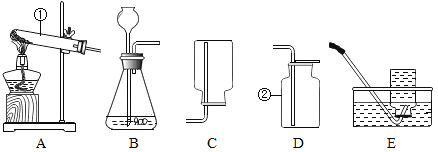
(1)写出上图所示装置中标有序号的仪器名称:①___________,②____________。
(2)实验室中用过氧化氢溶液与二氧化锰混合制取氧气,组装好仪器后,应先___________,再添加药品;收集氧气时,使用______(选填装置序号)所示的方法收集到的气体比较纯净。用E装置收集氧气的依据是___________;怎么验证收集到的气体是氧气_______________。当导管口开始有气泡产生时,不宜立即收集,原因是___________;
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小。氨气(NH3)极易溶于水。制取并收集氨气(NH3),应该从上图中选择的发生装置是_______(填序号)和收集装置是_______(填序号)。
【答案】试管 集气瓶 检查装置气密性 E 氧气难溶于水,且不与水反应 将带火星的木条伸入集气瓶中,观察木条是否复燃 刚开始排出的气体不是纯净的氧气,还混有装置内的空气 A C
【解析】
(1)装置中标有序号的仪器名称:①试管,②集气瓶。
(2)实验室中用过氧化氢溶液与二氧化锰混合制取氧气,组装好仪器后,应先检查装置气密性,再添加药品,避免装置气密性不好,造成药品浪费;氧气的密度大于空气,收集氧气时,用向上排空气法收集,使用E所示的方法收集到的气体比较纯净。用排水法E装置收集氧气的依据是:氧气难溶于水,且不与水反应;氧气具有助燃性,验证收集到的气体是氧气的方法:将带火星的木条伸入集气瓶中,观察木条是否复燃,若木条复燃,则说明收集到的气体是氧气;当导管口开始有气泡产生时,不宜立即收集,原因是:刚开始排出的气体不是纯净的氧气,还混有装置内的空气;
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。制取并收集氨气(NH3),应该从上图中选择的固体加热装置A,常温下氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小。氨气(NH3)极易溶于水。应该用向下排空气法收集,收集装置是C。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:初中化学 来源: 题型:
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%, 含Fe2O3、CuO、SiO2等约30%)生产大颗粒-氧化钇的一种工艺如下:
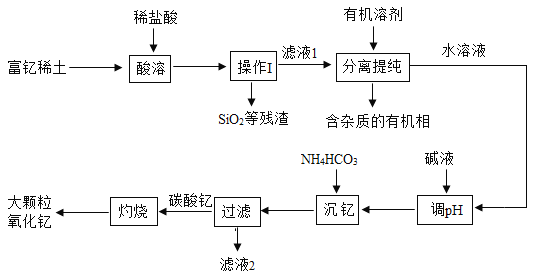
(1)操作I的名称是_____。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______。
(3)“分离提纯”是为了除去滤液1中的_____(填化学式)。
(4)“调pH”时加入碱液使溶液的pH_____(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是_____,此反应属于基本反应类型中的_____反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
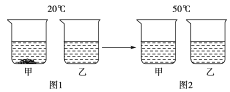
【题目】控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________ (填序号)受温度的影响,这就需要控制其他因素保持不变。
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) | 20 | 40 | 50 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.0 |
KNO3 | 31.6 | 63.9 | 85.5 | |
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热 | 量简中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:先将集气瓶内的空气排净,后便于观察H2何时收集满 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了二氧化锰对过氧化氢有催化作用的知识后。某同学想:氧化铜能否起到类似二氧化锰的催化剂作用呢?于是进行了如下探究。
(猜想)Ⅰ.氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ.氧化铜是反应的催化剂,反应前后_____和_____不变。
(实验)用天平称量0.2g氧化铜,取5mL 5%的过氧化氢溶液于试管中,进行如下实验:
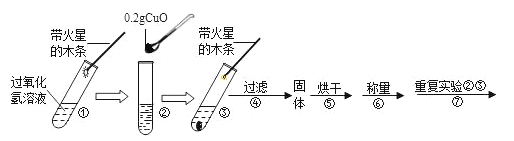
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_____, 带火星的木条复燃 | 所得固体 _____g | 溶液中有气泡放出, _____ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(2)步骤①的目的是_____。
(3)过氧化氢能被氧化铜催化分解放出氧气的化学反应的文字表达式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。
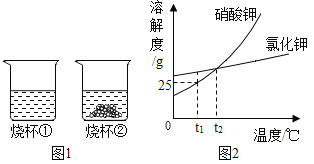
(1)烧杯②中的上层清液是否达到饱和状态?____(填“是”、“否”或“无法判断”);
(2)烧杯②中溶解的溶质是____(填化学式);
(3)t1℃时200g硝酸钾的饱和溶液中含有硝酸钾的质量为____g;
(4)关于图1 中烧杯内的物质,下列说法正确的是____。
A 烧杯①内溶液中溶质的质量分数<烧杯②内上层清液中溶质的质量分数
B 蒸发一定量的水,烧杯②一定有固体析出
C 将两个烧杯中的溶液混合,充分搅拌后,烧杯中可能还有氯化钾没有溶解
D 将温度升高到t2℃,烧杯②中固体一定全部溶解(不考虑水的蒸发)
E 将温度升高到t2℃,烧杯①内溶液的质量 = 烧杯②内溶液的质量(不考虑水的蒸发)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“宏观—微观”之间建立联系 是化学独特的思维方式。下图甲、乙两物质间反应的微观示意图,有关说法错误的是( )

A. 反应的化学方程式为NaOH + NaHSO4 = Na2SO4 + H2O
B. 反应属于复分解反应
C. 反应的微观实质是H+和OH-结合成H2O
D. 反应前后的离子个数没有改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属与人类生活密切相关。请分析回答下列问题:
(1)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:黄铜____纯铜(填“>”“<”或"=”);
(2)工业用赤铁矿石炼铁的反应原理是:![]() ,该反应中体现了CO具有______性;为测定某赤铁矿石中氧化铁的质量分数,用足量的一氧化碳与10g样品充分反应(杂质不能反应),若反应后剩余固体质量为m克,写出计算该赤铁矿石中氧化铁质量分数的表达式_________(用m表示).
,该反应中体现了CO具有______性;为测定某赤铁矿石中氧化铁的质量分数,用足量的一氧化碳与10g样品充分反应(杂质不能反应),若反应后剩余固体质量为m克,写出计算该赤铁矿石中氧化铁质量分数的表达式_________(用m表示).
(3)往![]() 溶液中加入一定量锌和铜的混合粉末,充分反应后,过滤,滤液为蓝色,则滤液中可能含有的金属离子是______(写离子符号),滤渣中一定含有的金属是________(写金属名称),
溶液中加入一定量锌和铜的混合粉末,充分反应后,过滤,滤液为蓝色,则滤液中可能含有的金属离子是______(写离子符号),滤渣中一定含有的金属是________(写金属名称),
(4)稀土元素铕是激光和原子能应用的重要材料。已知三氯化铕的化学式为![]() ,则氧化铕的化学式为__________。
,则氧化铕的化学式为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸雨给人类生活和社会发展带来了严重危害。汽车尾气是导致酸雨的重要原因,为减少有害气体的排放,人们在汽车排气管上安装催化转化器”,使尾气中的一氧化碳和一氧化氮转化为空气中体积分数最多的气体和CO2.回答下列问题:
(1)写出转化的化学方程式:______。
(2)化学反应中,元素的化合价升高,则该元素所在的反应物是还原剂,反之则为氧化剂。那么上述反应中的NO是______剂。
(3)实验室,若要充分吸收大量的CO2,下列试剂中最合适的是______(填序号)。
A水B澄清石灰水C饱和氢氧化钠溶液
(4)某同学通过查阅资料还得知:①CO容易和血红蛋白结合而使人中毒;②CO抗击侵入人体的微生物,并能阻止癌细胞的繁殖和肿瘤细胞的扩散。综合分析①和②的信息,你可以得到的启示是______。
(5)某化工厂准备生产Cu(NO3)2,以铜和稀硝酸为主要原料设计了两种方案
方案一:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4H2O
方案二:![]() ,CuO+2HNO3=Cu(NO3)2+H2O
,CuO+2HNO3=Cu(NO3)2+H2O
从环境保护的角度考虑,你认为较合理的方案是______,从经济效益的角度考虑,选择此方案的另一条理由是:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com