
| A. | 超临界CO2与常态下CO2的物理性质不同,化学性质相同 | |
| B. | 超临界CO2能代替许多有害、有毒、易燃的有机溶剂 | |
| C. | 用超临界CO2替代氟利昂可以减轻对臭氧层的破坏 | |
| D. | 超临界CO2是一种特殊的物质,容易燃烧 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:选择题
 钚是一种放射性元素,是原子能工业的一种重要原料,可作为核燃料和核武器的衰变剂,根据如图元素周期表,下列说法不正确的是( )
钚是一种放射性元素,是原子能工业的一种重要原料,可作为核燃料和核武器的衰变剂,根据如图元素周期表,下列说法不正确的是( )| A. | 该元素是金属元素 | B. | 该元素的原子序数为94 | ||
| C. | 该元素的相对原子质量是244g | D. | 该元素的中子数为150 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Zn+CuSO4=ZnSO4+Cu | B. | CuO+CO$\frac{\underline{\;高温\;}}{\;}$ Cu+CO2 | ||
| C. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 蒸发是初中阶段必须掌握的基本实验技能.
蒸发是初中阶段必须掌握的基本实验技能.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
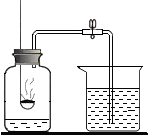 某同学用如图装置测定空气中氧气的体积分数.请你填写有关空格,并与同学交流.
某同学用如图装置测定空气中氧气的体积分数.请你填写有关空格,并与同学交流.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 该反应可能是铁与稀盐酸反应 | |
| B. | 反应物M2和R的质量比一定等于生成物W2和Q的质量比 | |
| C. | 若取10 g M2和10 g R反应,生成W2和Q的质量总和等于20 g | |
| D. | M2、R和 W2的相对分子质量分别是a、b、c,Q的相对分子质量可能是$\frac{a+2b-c}{2}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com