
【题目】汉黄芩素(C16H12O5)是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
A. 汉黄芩素中碳、氢、氧三种元素的质量比为16:12:5
B. 汉黄芩素的相对分子质量是284g
C. 汉黄芩素中氧元素的质量分数大于氢元素质量分数
D. 汉黄芩素中含有16个碳原子,12个氢原子和5个氧原子
 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】归的总结是学习化学的重要方法,小明同学用图1总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)
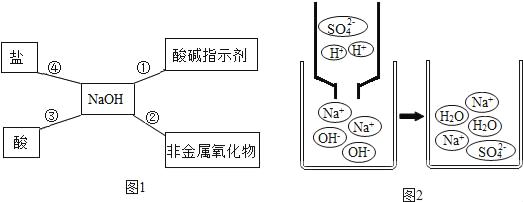
(1)为验证反应①,小明将无色酚酞溶液滴入NaOH溶液中,溶液变成_____色;
(2)反应②中,非金属氧化物为二氧化硫,则反应的化学方程式表示为:_____;
(3)小明用微观示意图(如图2)来说明反应③的发生,用化学方程式表示为:_____从该图中可以看出,反应后的溶液pH_____7(选填“>”、“<”或“=”)
(4)如果反应④能够发生,你选择的物质是_____(选填选项字母),理由是_____。
A Na2CO3 B HCl C CuSO4 D NaCl
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】固体物质A、B的溶解度曲线如右图所示,①②③④是分别用100g水配制的不同状态下A溶液,下列说法正确的是:
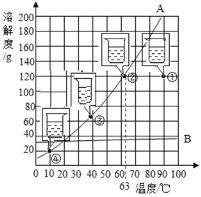
A. 状态①溶液不饱和,状态②③④溶液饱和
B. 60℃时A、B的饱和溶液降温至10℃时析出晶体质量A>B
C. 除去A中少量的B,常采用蒸发结晶的方法
D. ④的溶液质量分数最小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家在深海海底发现了大量未来太阳能光伏发电必需的元素——碲。碲元素在周期表中的信息如图所示。下列说法不正确的是( )
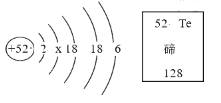
A. 碲是非金属元素
B. 碲的元素符号为 Te
C. 碲不能导电
D. 碲原子的中子数为 76
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】.如图所示,A~H 分别是氢、氧、硫、氯、钠、铜、钙、铁八种元素中的两种或几种组成的初中化学常见物质。“→”箭头表示物质间能转化,“—”表示物质间能反应),G 用于配制“波尔多液”,溶液显蓝色。请回答:
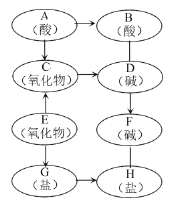
(1)G 的化学式为_____。
(2)C→D 的实验现象为:_____。
(3)写出下列化学方程式:
A→B:_____。
G→H:_____。
(4)在上述转化关系中,一定不包含_____反应(填基本类型)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学反应在防治环境污染中扮演了重要角色。某工厂废气中的SO2,可用以下方式处理。方式一:2SO2+O2+2CaO═2CaSO4;方式二:2SO2+O2+4NaOH═2Na2SO4+2H2O试计算:
(1)方式一反应的化学计量数之和为____;方式二反应前后硫元素的化合价变化为___。
(2)若用方式一处理9.6tSO2,所得产品价值____元?(写出计算过程)(已知:CaSO4的价格为700元/吨)
(3)若用方式二处理9.6tSO2,刚好用去50t一定浓度的NaOH溶液,求所得溶液的溶质质量分数____(最终结果精确到0.1%)。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2017年5月,中国科学家取得了将二氧化碳和氢气反应制取化工原料乙烯的重大突破。该化学反应的微观过程如下图所示。下列有关该化学变化的说法正确的是
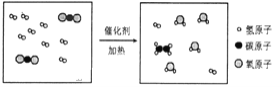
A. 生成物有3种物质
B. 从微观角度看,该化学变化改变的微粒是原子
C. 反应前后所有元素化合价都没有发生改变
D. 反应中各物质的化学计量数之和是13
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图中A~H是初中化学常见的物质。A俗称苏打;C可用作补钙剂;G是一种常见的氮肥,含氮量为35%;H、F物质类别相同。图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
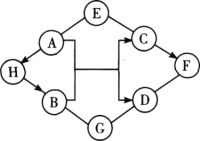
(1)写出化学式:A________,G________,D________。
(2)写出H转化为B的反应化学方程式:________。
(3)若E与G的组成元素相同,则E的名称为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为: H2C2O43H2O  CO2 ↑ + CO ↑ + 4H2O。工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某化学兴趣小组的同学利用草酸晶体制备一氧化碳,通过如下装置测定铁红中铁元素的质量分数。(装置气密性良好,试剂均足量。)
CO2 ↑ + CO ↑ + 4H2O。工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4。某化学兴趣小组的同学利用草酸晶体制备一氧化碳,通过如下装置测定铁红中铁元素的质量分数。(装置气密性良好,试剂均足量。)
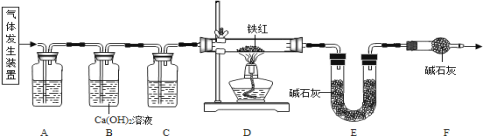
(1)下列可用作草酸分解制取气体的装置是__________(填字母编号)

(2)写出D装置中一氧化碳还原氧化铁的化学方程式____________。
(3)称取质量为m的铁红样品,用上述装置进行实验,测定铁红中铁的质量分数。
①反应结束后D中得到Fe粉的质量x,则x的取值范围为____________(用m的代数式表示)。
②若充分反应后,称得E装置增重n,则此铁红中铁的质量分数是_________(用m、n的代数式表示)。
(4)关于该实验,下列说法正确的是_____________。
①进入D中的气体是纯净、干燥的CO,则A、C中的试剂分别是浓硫酸和澄清石灰水
②对D装置加热前和停止加热后,都要通入过量的CO,其作用都是防止爆炸
③装置F的作用是防止空气中的二氧化碳和水蒸气进入到装置E中
④实验装置有一明显的缺陷是没有尾气处理装置
⑤若没有装置C,则测定的铁元素的质量分数会偏大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com