
【题目】根据初中学习的化学知识回答下列问题:
① 霓虹灯中充入的气体是_____;
② 人工降雨常使用干冰,干冰的化学式是_____;
③ 能够还原氧化铜的非金属单质的化学式是_____;
④ 某物质焰色反应呈黄色,说明该物质中一定含有_____元素;
⑤ 引起酸雨的主要物质是_____,它是一种酸性氧化物,实验室可用_____吸收以减少污染;
⑥ 稀硫酸可用于除去铁锈,反应的化学方程式是_____。
【答案】 氦气(或稀有气体) CO2 C或H2 钠 二氧化硫 熟石灰或氢氧化钠 Fe2O3 + 3H2SO4![]() Fe2(SO4)3 + 3H2O
Fe2(SO4)3 + 3H2O
【解析】①根据稀有气体化学性质不活泼,可作电光源解答;②根据干冰是固态二氧化碳解答;③根据碳或氢气有还原性解答;④根据焰色反应是元素的性质,只要含有Na元素,灼烧时其焰色就为黄色来分析解答;⑤根据引起酸雨的主要物质是二氧化硫及熟石灰或氢氧化钠能与氢氧化钠反应解答;⑥根据稀硫酸与氧化铜反应生成硫酸铁和水解答。①稀有气体化学性质不活泼,可作电光源。故霓虹灯中充入的气体是氦气(或稀有气体);②干冰是固态二氧化碳,二氧化碳的化学式为CO2;③碳或氢气有还原性。故能够还原氧化铜的非金属单质是碳或氢气,其化学式是C或H2;④ 某物质焰色反应呈黄色,说明该物质中一定含有钠元素;⑤引起酸雨的主要物质是二氧化硫,它是一种酸性氧化物,实验室可用熟石灰或氢氧化钠吸收以减少污染;⑥稀硫酸与氧化铜反应生成硫酸铁和水,反应的化学方程式为Fe2O3 + 3H2SO4→Fe2(SO4)3 + 3H2O。


科目:初中化学 来源: 题型:
【题目】25℃时,向20.0mL质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示。下列有关叙述正确的是

A.b、d点对应溶液的pH:b>d
B.所用氢氧化钠溶液的质量分数一定为30%
C.向b点对应的溶液中滴加石蕊溶液,溶液呈无色
D.d点对应的溶液中溶质是NaCl和NaOH
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包白色粉末可能含硫酸钡、碳酸钠、和氢氧化钡中的一种或几种,取一定量的该粉末加入到盛有足量水的烧杯中,搅拌、静置,观察到有白色不溶物。
小张同学认为,白色粉末中一定含有硫酸钡;
小李同学认为,小张同学的结论不准确,其理由可用化学方程式表示为______________。
针对上述两名同学的观点,小刘同学进一步设计如下实验方案进行探究:

(1)步骤③中,滴入酚酞溶液后,若滤液E为红色,则滤液E中除酚酞外还一定含有的溶质是_______(填化学式,下同),由此得出原白色粉末成分组成的结论是______________。
(2)小王同学认为,只需要取少量滤渣B,加入过量的稀盐酸,若看到的现象是白色不溶物部分溶解,且有气泡产生,就足以说明原白色粉末的成分是__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种固体(均不含结晶水)的溶解度曲线。

①t1℃时,甲物质的溶解度为________ g/100g 水;
②t2℃时,将50g甲放入100g水中,充分搅拌后所得溶液的溶质质量分数为____;
③t1℃时,将甲、乙的饱和溶液分别升温至t2℃,此时要使甲、乙溶液的浓度相等,可实现的下一步操作是______。
A.向甲溶液中加入固体甲 B.向甲溶液中加入水
C.向乙溶液中加入固体乙 D.向乙溶液中加入水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小苏打是发酵粉的主要成分之一,可用于制作发面食品.一化学兴趣小组对某小苏打样品中各成分的含量做了如下测定:将一定质量的该样品(已知杂质只含NaCl)加水全部溶解后,得到104.4g溶液,向该溶液中逐渐加入稀盐酸,产生的气体与加入稀盐酸的质量关系如图所示.试计算:
(1)m的值为 .
(2)当恰好完全反应时,所得溶液的溶质质量分数为3%,求原小苏打样品中NaHCO3与NaCl的质量比 .

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活密切相关。
(1)水与溶液
①含有较多钙、镁离子的天然水称为硬水,生活中常用_________来区别硬水和软水。热水壶的内胆常附有水垢(主要成分为碳酸钙和氢氧化镁),可用厨房用品中的______清洗水垢。
②某固态物质的溶解度曲线如图所示。
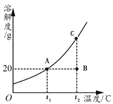
Ⅰ.若将B点状态溶液变化为A点,简单的实验操作为_________。
Ⅱ.取用某一温度下的该固态物质饱和溶液时,下列物理量不随所取溶液体积的多少而变化的是_______(填标号)。
A.溶液中溶质的质量 B.溶液的质量
C.溶液的溶质质量分数 D.溶液的密度
(2)黑木耳是一种含铁丰富的食用菌。
①黑木耳中所含的“铁”是指______(填“分子”“原子”或“元素”)。
②常吃黑木耳能有效预防人体缺铁而引发的疾病是__________。
③黑木耳中的铁可以用KSCN溶液与铁离子作用生成Fe(SCN)3来检测。在Fe(SCN)3中C、N的化合价分别是+4、-3,则S的化合价是_______;Fe(SCN)3中铁元素的质量分数为___(列出计算式即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线。
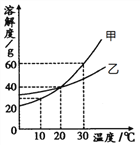
(1)要使接近饱和的甲物质的溶液变为饱和溶液,在不改变溶质质量分数的前提下,可采用的方法是____________;
(2)20℃时,将50 g乙物质放入100 g水中,充分溶解后所得溶液的溶质质量分数为________;(精确到0.1%)
(3)30℃时,若要配制320g甲物质的饱和溶液,需要溶解____________ g甲物质。
(4)从图中你可以得到哪些信息?__________________任写一条)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铝及化合物有极其重要的用途。
(一)铝的广泛应用
(1)铝是很活泼的金属,但用铝制作的炊具却耐腐蚀,其原因是_________。使用铝制炊具会使人体摄入过量的“铝”,导致记忆力减退等许多不良症状。这里的“铝”是指________。
A. 单质 B. 元素 C. 原子 D. 分子
(2)氢能源是最理想的能源,科学家研发出一种以“铝镓合金”和水为原料制取氢气的新工艺。“铝镓合金”它属于________(选填序号)。
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(3)实验室可用铝片与稀盐酸反应制备氢气,写出该反应的化学方程式:_________。
(二)硫酸铝铵晶体制取的探究
硫酸铝铵是一种用途广泛的含铝化合物。以某铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3杂质)为原料制硫酸铝铵晶体【(NH4)aAlb(SO4)c·xH2O】的流程如下:
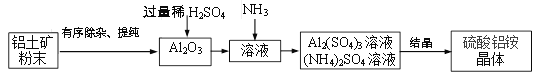
(4)铝土矿粉碎的目的是__________。
(5)有关上述流程的说法正确的是_________。
a.“有序除杂、提纯”中有先加过量稀盐酸再过滤,该做法的目的是除去SiO2
b. 稀硫酸过量的目的只是保证Al2O3溶解完全
(三)硫酸铝铵晶体分解的定性探究
硫酸铝铵热分解可得到纳米氧化铝。兴趣小组在科研人员指导下,设计实验探究硫酸铝铵晶体受热分解的产物。
(6)甲组同学设计了如图1所示实验装置:
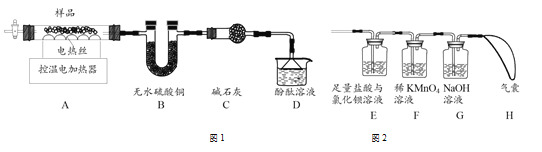
①实验中,装置B中观察到的现象是___________;
②装置D中观察到酚酞溶液变红色,由此可知分解的产物中有_________(写化学式)。
(7)乙组同学认为硫酸铝铵晶体受热分解的产物中还有SO2、SO3和N2。为进行验证,用甲组实验中的装置A和上图2所示装置连接进行实验。观察到装置E中_______,证明了有SO3生成;而F装置中__________、H最终没有胀大,表明没有SO2和N2生成。
(四)硫酸铝铵晶体成分的定量探究
(8)为确定硫酸铝铵晶体的组成,进行如下实验:
【实验1】称取45.3g样品与足量氯化钡溶液充分反应,生成白色沉淀46.6g。
【实验2】称取45.3g样品在空气中持续加热,测定剩余固体质量随温度变化的曲线如图所示。
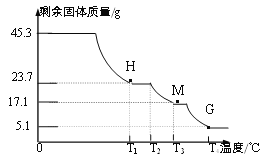
①固体H是T1℃刚好完全失去结晶水的产物,
则结晶水的个数x=________;
②T3℃时固体M的化学式______。
③请写出T2℃→T4℃段发生反应的总化学方程式:__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知M、N分别是稀硫酸、氢氧化钠溶液中的一种。某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如下图所示:
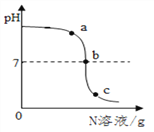
(1)M是______________。
(2)反应过程中,老师分别取图中a、b、c三处所对应的溶液,打乱顺序后,请同学们用一定的方法将三种溶液加以鉴别(不用测定溶液pH的方法)。
小明和小红分别取其中一种溶液进行实验:小明向所取溶液中加入___________溶液,观察到有蓝色沉淀生成。
结论:是a处溶液。
小红向少量另一种溶液中滴加酚酞溶液,观察到____________。
结论:是b处或c处溶液。
为进一步确定该溶液成分,小红又设计并完成如下实验:
实验步骤 | 实验现象 | 结论及化学方程式 |
取少量氧化铁,加入足量该溶液 | 固体完全溶解,且_____________ | 相关的化学方程式为_____________。 为c处溶液,并推知c处溶液中含有的离子有_____________(填写离子符号) |
结论:剩余一种为b处溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com