
分析 (1)根据原子(分子)间质量比,与相对原子(分子)质量比相等,相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据元素是质子数相同的一类原子的总称,所以分子中原子质量比=元素质量比,原子质量分数和元素的质量分数相同回答;
(3)根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答.
解答 解:(1)原子(分子)间质量比,与相对原子(分子)质量比相等;
一个氢原子的相对原子质量是1,一个水分子的相对分子质量为1×2+16=18,所以一个氢原子与一个水分子的质量比是:1:18;
一个二氧化碳分子的相对分子质量为12+16×2=44,所以一个水分子与一个二氧化碳分子的质量比是18:44=9:22;
(2)水的化学式是H2O,可知一个水分子中氢原子和氧原子的质量比是:(1×2):16=1:8;
氢原子的质量分数=$\frac{2×1}{18}$×100%≈11.1%;
(3)二氧化碳中碳元素的质量分数是$\frac{12}{44}$×100%≈27.3%?
故答案为:(1)一个氢原子与一个水分子的质量比是1:18;一个水分子与一个二氧化碳分子的质量比是9:22;
(2)一个水中分子中氢、氧原子质量比是1:8;氢原子的质量分数是11.1%;
(3)二氧化碳中碳元素的质量分数是27.3%.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
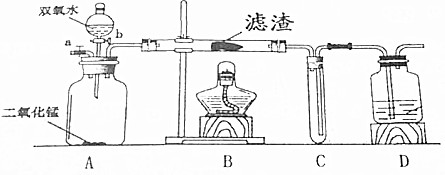
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
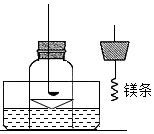 某科学兴趣小组查阅资料得知镁可在氧气中燃烧生成氧化镁,可在氮气中燃烧生成氮化镁,于是设计了如下方案进行验证.
某科学兴趣小组查阅资料得知镁可在氧气中燃烧生成氧化镁,可在氮气中燃烧生成氮化镁,于是设计了如下方案进行验证.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
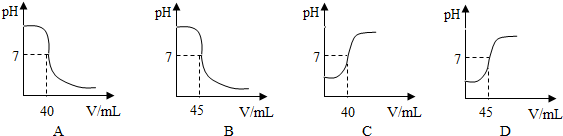
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com