
| A. | 化学式不同,其相对分子质量也一定不同 | |
| B. | 某物质含分子数越多,则该物质的相对分子质量也越大 | |
| C. | 氧气的相对分子质量为32g | |
| D. | KClO3的相对分子质量为122.5 |
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图为大家经常使用的某品牌修正液标签上的部分文字和图片.请分析、推测该修正液的性质(至少答出三点):
如图为大家经常使用的某品牌修正液标签上的部分文字和图片.请分析、推测该修正液的性质(至少答出三点):查看答案和解析>>
科目:初中化学 来源: 题型:填空题
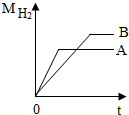 等质量的A、B两种活泼金属(化合价均为+2价)与足量稀盐酸反应,产生H2质量与反应时间的函数关系如图所示.
等质量的A、B两种活泼金属(化合价均为+2价)与足量稀盐酸反应,产生H2质量与反应时间的函数关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A灭火实例与原理 油锅着火时用锅盖盖灭--隔绝空气 住宅失火时用水灭火--降低着火点 扑灭森林火灾时设置隔离带--隔离可燃物 | B物质与性质 硝酸铵--溶于水时吸热 加碘食盐--“碘”是指元素 锰酸钾--锰元素的化合价为+7 |
| C食品与安全 亚硝酸钠--不能当食盐用 霉变食物--高温消毒后可食用 甲醛溶液--可作食品保鲜剂 | D物质与用途 活性炭--可用于吸附冰箱内的异味 酒精--可用于除去衣服上的碘渍 铝合金--可用作制造飞机 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com