
【题目】超市卖的纯碱产品中往往含有少量的氯化钠,某化学兴趣小组的同学通过实验来测定某纯碱样品中碳酸钠的质量分数。兴趣小组取15 g纯碱样品,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答问题:

(1)当滴加稀盐酸至图中A点时,烧杯中溶液里的溶质是 _ 。(写化学式)
(2)该纯碱样品中碳酸钠的质量分数是多少? (写出计算步骤,计算结果精确到0.1%)
(3)恰好完全反应时,溶液中溶质的质量为多少?
【答案】(1)NaCl;(2) 70.7%(3)16.1g
【解析】(1)当滴加稀盐酸至图中A点时,溶液中的碳酸钠完全和滴加的稀盐酸反应生成CO2和NaCl、水,则此时溶液中的溶质只有NaCl;
(2)设样品中碳酸钠的质量为x,反应中生成的NaCl质量为y,生成的二氧化气体质量为z;
Na2CO3 + 2HCl = 2NaCl +H2O + CO2↑
106 73 117 44
x 73g×10% yg zg
![]() =
=![]() =
=![]() =
=![]() ,解得:x=10.6g,y=11.7g,z=4.4g;
,解得:x=10.6g,y=11.7g,z=4.4g;
纯碱样品中碳酸钠的质量分数是![]() =70.7%;
=70.7%;
(3)滴加73g稀盐酸时恰好完全反应,此时溶液中NaCl的质量为15g-10.6g+11.7g=16.1g。


科目:初中化学 来源: 题型:
【题目】含锌废液和各种锌矿(如菱锌矿)都有着重要的用途。
I.以含锌废液(主要成分为![]() ,杂质为
,杂质为![]() 、
、![]() )为原料制备七水硫酸锌(
)为原料制备七水硫酸锌(![]() )的流程如下。
)的流程如下。
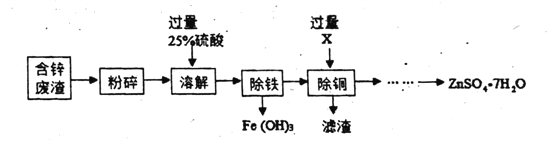
(1)粉碎的目的是__________________________________。
(2)物质X是一种金属单质,则X是____________(填化学式),除铜时发生的反应属于________反应(填基本反应类型)。
(3)七水硫酸锌的溶解度曲线与硝酸钾类似。流程中获得七水硫酸锌前省略的操作是加热浓缩、____________、过滤、洗涤和低温烘干。
II.以某菱锌矿(![]() 含量为62.5%)为原料制备锌的一种方法是(杂志不参与反应):先将焦炭和菱锌矿在
含量为62.5%)为原料制备锌的一种方法是(杂志不参与反应):先将焦炭和菱锌矿在![]() 时煅烧,然后加热蒸馏得到锌,则100吨这样的菱锌矿理论上能制得锌_____________吨。(提示:
时煅烧,然后加热蒸馏得到锌,则100吨这样的菱锌矿理论上能制得锌_____________吨。(提示: ![]() 高温 ZnO + CO2↑)
高温 ZnO + CO2↑)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关合金的说法正确的是
A.合金中一定不含非金属
B.生铁可以完全溶解在足量的稀盐酸中
C.合金的硬度一般比各成分金属大
D.各成分金属的熔点比合金的熔点低
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于二氧化碳的说法错误的是
A. 二氧化碳可用于制碳酸类饮料
B. 二氧化碳是一种有刺激性气味的有毒气体
C. 干冰可用于人工降雨
D. 大气中CO2消耗途径主要是植物的光合作用
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某班4同学用pH 试纸测得以下液体的pH 及其判断都正确的是
A. 胃液pH=9 混合物 pH 试纸变红色
B. 纯碱水pH=10 碱溶液 酚酞试液变红色
C. 食盐水pH=7 显中性 pH 试纸不变色
D. 雨水 pH=5 显酸性 石蕊试液变蓝色
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了除去氯化钠样品中的碳酸钠杂质,某兴趣小组将样品溶解后进行如下实验:

(1)A溶液中溶质可能为____________(只写一种);
(2)将无色溶液与沉淀B分离的操作①的方法名称是_____________;
(3)从无色溶液得到固体物质C的操作②的方法名称是____________;
(4)因为A溶液过量,此方案得到的固体物质C中混有新的杂质,为了既能除去杂质碳酸钠,又能有效地防止新杂质的引入,可向样品溶液中加入过量的_____________后,直接进行操作②即可得到纯净的氯化钠固体。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关主题知识的归纳错误的是
A.元素与人体健康:人体缺碘---易造成甲状腺疾病
B.认识元素:海水中含量最多的元素是---氢
C.变化与能量:蜡烛燃烧---释放能量
D.物质的性质与用途;氧气具有助燃性---可用于火箭的助燃剂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体.小组的同学对蓝色固体的成分进行了如下探究.
【猜想假设】
猜想一:固体为CuCO3,理由:____________(用化学反应方程式表示).
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈__________(填“酸”或“碱”)性.
猜想三:固体为Cu(OH)2和CuCO3的混合物.
【资料查阅】
①Cu(OH)2、CuCO3受热分解,各生成对应的两种氧化物;
②Cu(OH)2的分解温度为66℃—68℃,CuCO3的分解温度为200℃—220℃;
③无水硫酸铜为白色固体,遇到水以后会变成蓝色.
【实验探究】
Ⅰ.固体的获取
(1)将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体.
(2)判断固体已洗净的方法及现象_______________.
Ⅱ.定性探究固体的成分
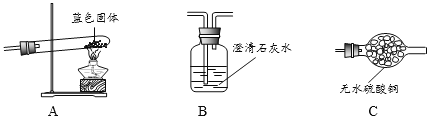
(3)小组同学将装置按 A、____________(填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的,实验中:A中固体发生的现象为__________ B中的化学方程式_____________.
结论:固体为Cu(OH)2和CuCO3的混合物.
Ⅲ.固体成分定量测定:
小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图:
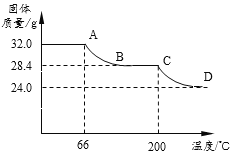
请根据图示回答下列问题:
(4)写出CD段反应的化学方程式______;
(5)计算Cu(OH)2的质量为_________g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com