
【题目】科学城中学一化学兴趣小组选用如图所示装置,进行CO2的制取和性质实验,请你根据所学知识,依图回答下列问题:
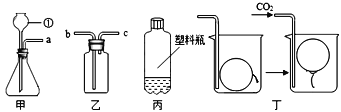
(1)写出图中仪器①的名称_______。
(2)装置甲中反应的化学方程式为_______。
(3)用装置乙排空气收集二氧化碳,验满时,燃着木条应放在_______ (填“b”或“c”)端。
(4)用图丙所示的质地较软的塑料瓶收集满CO2,再倒入一定量的紫色石蕊溶液,立即旋紧瓶盖,振荡,观察到的现象是_______。
(5)往图丁的烧杯内缓缓通入CO2,超薄材料做成的内充空气的气球会慢慢浮起,由此得出CO2具有的性质是_______。
(6)实验结束后,甲装置中仍然有固体,写出该装置中溶液里含有的微观粒子符号_______。
【答案】长颈漏斗 CaCO3+2HCl===CaCl2+H2O+CO2↑ c 瓶子瘪了,溶液变红色 二氧化碳气体的密度比空气大 Ca2+、Cl-、H2O
【解析】
(1)图中仪器①的名称是长颈漏斗。
(2)实验室用大理石或石灰石与稀盐酸反应制得二氧化碳,大理石的主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水和二氧化碳;化学反应方程式为:CaCO3+2HCl===CaCl2+H2O+CO2↑。
(3)用装置乙排空气收集二氧化碳,验满时,由于二氧化碳密度比空气大,燃着木条应放在c端。
(4)二氧化碳与水反应生成碳酸,碳酸是一种酸,能使紫色的石蕊试液变红色,由于二氧化碳和水发生了反应,瓶内气体压强减小,故可以看到瓶子瘪了,溶液变红色的现象。
(5)往图丁的烧杯内缓缓通入CO2,超薄材料做成的内充空气的气球会慢慢浮起,由此得出CO2具有的性质是二氧化碳气体的密度比空气大。
(6)实验结束后,甲装置中仍然有固体,说明稀盐酸全部反应,故该装置中溶液里含有的溶质只有反应生成的氯化钠,故该装置中溶液里含有的微观粒子符号为:Ca2+、Cl-、H2O。


科目:初中化学 来源: 题型:
【题目】为测定空气中氧气的体积分数,小花同学按图甲所示的装置进行了多次实验,发现每次测得的氧气体积分数总是远小于21%,他认为误差主要由实验装置造成,于是改用图乙装置进行实验。
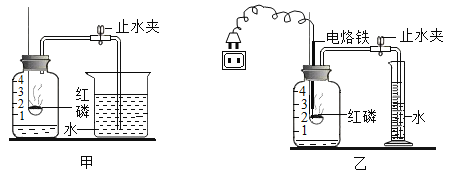
①小花按如甲装置进行实验时,该如何检查装置的气密性_____。
②与装置甲相比,装置乙可以减小实验误差,其原因是_____。
③小强同学按图1所示装置测定空气中氧气的含量,并用压强传感器实时地传回集气瓶内压强一时间关系图(该装置气密性良好,P0是集气瓶内初始气压,P1和P2分别是反应结束后恢复到室温时集气瓶内的气压),下列说法正确的是_____。
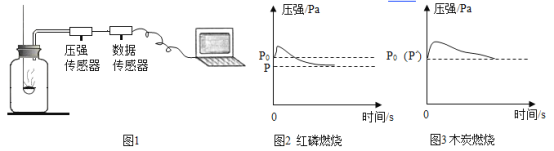
A 燃烧匙内所装红磷或木炭的多少对实验结果无影响
B 反应开始时集气瓶中压强瞬间变大是由燃烧放热造成
C P1=0.79P0,P2=P0是因为红磷比木炭消耗的氧气多
D 由图3可推出空气中氧气的含量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入广口瓶中,振荡,一段时间后可见小气球a膨胀鼓起。下表中的各组物质不会出现上述现象的是( )
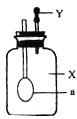
X | Y | |
A | CO | Ca(OH)2溶液 |
B | CO2 | NaOH溶液 |
C | HCl | Ca(OH)2溶液 |
D | SO2 | NaOH溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组在实验室里进行木炭还原氧化铜的实验。
(实验1)装置如图。
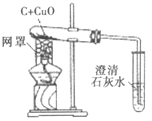
(1)木炭还原氧化铜的化学方程式为__,当碳与氧化铜的质量比为__(写最简整数比)时恰好完全反应。
(2)下列有关本实验的说法正确的是____(填字母)。
A 酒精灯加网罩以使火焰集中并提高温度
B 氧化铜发生了还原反应,木炭发生了氧化反应
C 观察到石灰水变浑浊即可证明氧化铜被还原了
D 反应后先撤出导气管,待试管冷却后再把其中的粉末倒出
(提出问题)实验1中,加热5分钟后仅能得到混有少量红色固体的黑色粉末。如何让木炭还原氧化铜时得到更多的铜呢?
(实验2)该小组同学在老师的指导下改进了实验,装置如图,加热2分钟后即得到紫红色有金属光泽的块状固体,且无黑色固体剩余。
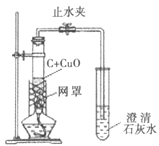
(1)刚烘干的木炭粉末与氧化铜粉末要在同一个研钵内充分研磨、混合均匀后再放入试管,这样做能使反应更充分,其主要原因是__。
(2)本实验所用的木炭与氧化铜的质量比为1︰10,碳需要略过量才能使氧化铜全部被还原,其主要原因是____。
(3)反应物放入试管后要尽量压实,并将试管竖直进行加热,使其下部完全被外焰包围,受热均匀,获得持续的高温。
(4)反应后关闭止水夹,让产物自然冷却,这时试管里残余的________就成了保护气。
(5)加了网罩的酒精灯火焰最高温度能达到800℃,而铜的熔点是1083℃。本实验获得了经熔化而成珠状或小块状的铜,可以推测木炭还原氧化铜的反应是________热量的。
(查阅资料)木炭还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
(拓展探究)将实验2得到的紫红色有金属光泽的块状固体全部研磨成粉末。
(1)将全部粉末放入烧杯中,加入足量稀硫酸,充分反应后,观察到______,证明实验2得到的铜中含有氧化亚铜;再经过滤、洗涤、干燥,得到纯净的单质铜1.52g。
(2)已知实验2使用的氧化铜粉末的质量为2.00g,不考虑实验过程中的损耗,则实验2得到的紫红色有金属光泽的块状固体中,单质铜的质量分数为______(计算结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
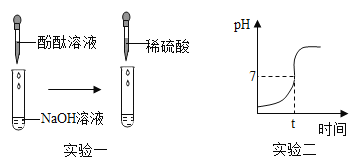
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A 将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | 得到蓝色溶液,无_____ | 氢氧化钠和硫酸发生了化 学反应 |
(拓展延伸)同学们对氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分产生了浓厚的兴趣,于是进行了进一步的探究。
(提出问题)氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分
(提出猜想)猜想一:Na2SO4猜想二:Na2SO4和H2SO4你的合理猜想是:_____。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
取少量反应后的溶液置于试管中_____ | _____ | 猜想二正确 |
(实验反思)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑反应物是否有剩余。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线交于点P。据图回答:

(1)P点的含义是_____。
(2)t1℃时,30g的a物质加入到50g水中不断搅拌,能形成80g溶液吗?_____(填“能”或“不能”)
(3)t2℃时a、b、c三种物质的溶解度由大到小的顺序排列的是_____(填写物质序号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁是常见的金属元素,它在元素周期表中的信息如图所示,下列有关说法错误的是( )
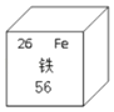
A. 铁原子的核外电子数为26,中子数为30
B. 该元素组成的单质是目前世界年产量最高的金属
C. 该元素是地壳中含量最高的金属元素
D. 该原子的相对原子质量为56
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习了二氧化锰过氧化氢分解有催化作用的知识后,某兴趣小组的同学提出问题:氧化铁能否起到类似于二氧化锰的催化作用呢?于是他们进行了以下探究.
(猜想)
Ⅰ.氧化铁不是反应的催化剂、也不参与反应,质量和化学性质反应前后均不变;
Ⅱ.氧化铁参与反应产生氧气,反应前后质量不变,但化学性质发生了改变;
Ⅲ.氧化铁是反应的催化剂,反应前后_____.
(实验)用天平称0.2g氧化铁,用试管取5mL 5%的过氧化氢溶液,进行如下实验:
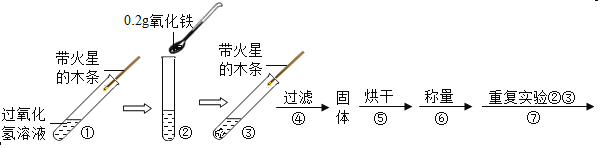
(注:氧化铁不溶于水,过滤可与水分离)
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
带火星的木条复燃. | _____ | 过氧化氢溶液中:_____ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立. |
(2)步骤①的目的是_____.
(3)写出上述有关过氧化氢分解的文字表达式_____.
(4)步骤⑦重复实验②、③的目的是_____.
(继续探究)从上述实验得出氧化铁是反应的催化剂.对同种催化剂,有哪些因素可能影响催化效果?请提出猜想并设计实验进行探究._____(注意:至少探究两种因素,答对一种因素奖励2分,本題最多奖励4分,化学试卷总分不超过60分)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】写出下列反应的化学方程式。
(1)工业炼铁的主要反应原理:______
(2)含小苏打的药物治疗胃酸过多症:_____
(3)用稀盐酸除去铝片表面的氧化膜:_______
(4)工业上用贝壳、石灰石、白垩等物质制取生石灰:_______
(5)天然气完全燃烧:_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com