
 2CuO+H2O+CO2↑;
2CuO+H2O+CO2↑; 2CuO+H2O+CO2↑;(3)Cu+2AgNO3═2Ag+Cu(NO3)2;(4)2NaOH+H2SO4═Na2SO4+2H2O;
2CuO+H2O+CO2↑;(3)Cu+2AgNO3═2Ag+Cu(NO3)2;(4)2NaOH+H2SO4═Na2SO4+2H2O;

科目:初中化学 来源: 题型:阅读理解

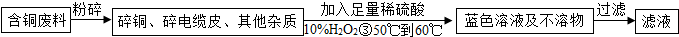
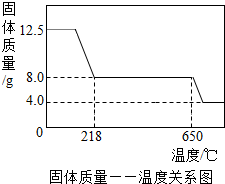
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 有一种矿石称为“孔雀石”,它有孔雀羽毛般绿色斑纹,它的主要成分是碱式碳酸铜[Cu2(OH)2CO3].因碱式碳酸铜中含有铜元素,某兴趣小组同学对如何从孔雀石中提炼金属铜产生了浓厚兴趣,为此采集了适量的孔雀石样品,在老师的指导下进行了下列探究活动.
有一种矿石称为“孔雀石”,它有孔雀羽毛般绿色斑纹,它的主要成分是碱式碳酸铜[Cu2(OH)2CO3].因碱式碳酸铜中含有铜元素,某兴趣小组同学对如何从孔雀石中提炼金属铜产生了浓厚兴趣,为此采集了适量的孔雀石样品,在老师的指导下进行了下列探究活动.| 步骤和方法 | 现象 | 分析 |
| 取7.2g红色固体,置于烧杯中,向其中加入足量的稀硫酸,充分搅拌,静置. | 若无变化现象. | 证明红色固体是 Cu Cu . |
| 若 溶液变蓝色 溶液变蓝色 . |
证明红色固体肯定含有 Cu2O Cu2O . | |
| 取上述反应后的溶液过滤,洗涤、干燥和称量,得固体质量为6.8g. | ╱ | 确认红色固体是 Cu和Cu2O的混合物 Cu和Cu2O的混合物 . |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 /g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________
2CuO+H2O+CO2↑,古代人们发现翠绿的孔雀石在森林大火中会变成红色的铜,请写出转化为铜的另一个反应方程式:________| 金属 | Ti | Mg | Ag |
| 反应现象 | 反应缓慢 | 反应强烈 | 无明显现象 |
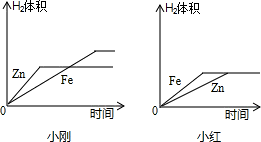
| 次数 | 1 | 2 | 3 | 4 |
| 加入酸质量/g | 5.0 | 5.0 | 5.0 | 5.0 |
| 剩余固态质量/g | 4.5 | 4 | 3.5 | 3.2 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年山东省潍坊市九年级学业水平考试化学模拟试卷(解析版) 题型:解答题

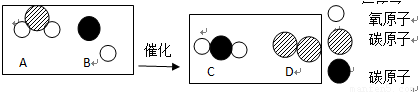
| 温度/℃ | 20 | 40 | 60 | 80 | 100 | ||
| 溶解度 /g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com