
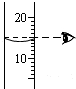
 在t℃时,称量5.2g氢氧化钠,投入到15g水中搅拌,固体全部溶解.冷却到t℃后有0.2g固体析出.判断下列正确的是
在t℃时,称量5.2g氢氧化钠,投入到15g水中搅拌,固体全部溶解.冷却到t℃后有0.2g固体析出.判断下列正确的是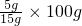 =30g,故选项说法错误.
=30g,故选项说法错误.

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
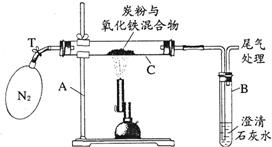
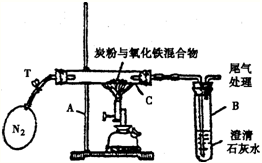 (2005?湘潭)某化学兴趣小组的学生研究过量的碳粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:
(2005?湘潭)某化学兴趣小组的学生研究过量的碳粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
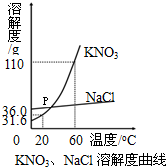
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| KNO3/g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| NaCl/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.8 |
查看答案和解析>>
科目:初中化学 来源:黑龙江省中考真题 题型:填空题
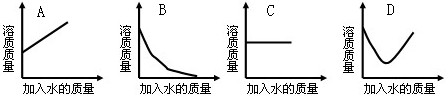
 。
。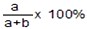 ,若要使其溶质质量分数变为原来的1/2倍,需加水_________克。
,若要使其溶质质量分数变为原来的1/2倍,需加水_________克。查看答案和解析>>
科目:初中化学 来源:2006年第十六届“天原杯”全国初中学生化学素质和实验能力竞赛(江苏赛区)初赛试卷(解析版) 题型:解答题
 4Fe+3CO2↑ C+C02
4Fe+3CO2↑ C+C02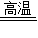 2CO
2CO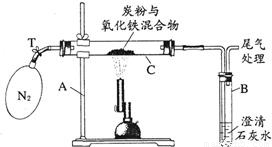
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com