解:(1)①地壳中含量比较多的前五种元素是:氧、硅、铝、铁、钙;故填O;
②造成硫酸型酸雨的气体为二氧化硫,根据读法,二氧化硫可表示为:SO
2;
③炉具清洁剂含有氢氧化钠,钠元素是正一价,氢氧根是负一价,根据化合价原则,其化学式可表示为:NaOH;
④有机物是由碳元素组成的化合物,故由三种元素组成的有机物可表示为:C
2H
5OH;
⑤碳酸分解生成二氧化碳和水,二者都为氧化物,且反应为分解反应,反应的化学方程式为:H
2CO
3=CO
2↑+H
2O;
⑥由以上元素组成的难溶性盐为CaCO
3或CuCO
3,CaCO
3与盐酸反应生成CaCl
2、CO
2和H
2O,反应的化学方程式为:CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;
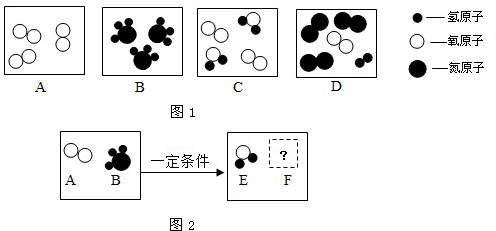
(2)由图示的情况可知:A中含有3个氧气的分子,B中含有的是3个氨气分子(NH
3);由于C中含有2个水分子和2个氧气分子;D含有3个氮气分子和1个氢气分子1个氧气分子,所以C、D均是混合物,A是氧气的单质.故B图表示:3NH
3;表示混合物的有CD;
(3)①F是氮气时其反应物是氧气与氨气,产物是水与氮气,其方程式是3O
2+4NH
3
6H
2O+2N
2,则水与氮气的质量比=(6×18):(4×14)=27:14;
②依据质量守恒定律可知F一定是氮的氧化物,因AB的分子个数比5:4,进而写出方程式是5O
2+4NH
3
6H
2O+4NO.
故答案为:(1)①O ②SO
2 ③NaOH ④C
2H
5OH (合理均对)⑤H
2CO
3=CO
2↑+H
2O ⑥CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;
(2)①NH
3 ②CD (3)①27:14 ②5O
2+4NH
3
6H
2O+4NO;
分析:(1)根据地壳中含量比较多的前五种元素是:氧、硅、铝、铁、钙;造成硫酸型酸雨的气体是二氧化硫;炉具清洁剂含有氢氧化钠;有机物是由碳元素组成的化合物;碳酸分解生成二氧化碳和水,二者都为氧化物,且反应为分解反应;由以上元素组成的难溶性盐为CaCO
3或CuCO
3.
(2)①利用图示中有关的物质的分子结构的知识对微粒的个数以及对分子的结构进行分析;
②混合物含有多种分子.
(3)①F是氮气时其反应物是氧气与氨气,产物是水与氮气,可书写出化学反应方程式,并对生成物的质量关系进行计算;
②依据质量守恒定律可知F一定是氮的氧化物,用AB的分子个数比可确定其化学式,进而写出方程式.
点评:本题主要考查了依据特定的条件书写化学式和书写化学方程式,书写化学用语时一定要规范,准确.利用分子由原子构成,同种原子构成的分子为单质分子,不同种原子构成的分子为化合物分子,纯净物中只含一种分子,混合物含有多种分子分析解答即可.

 6H2O+2N2,则水与氮气的质量比=(6×18):(4×14)=27:14;
6H2O+2N2,则水与氮气的质量比=(6×18):(4×14)=27:14; 6H2O+4NO.
6H2O+4NO. 6H2O+4NO;
6H2O+4NO;

 名校课堂系列答案
名校课堂系列答案